Какой процесс называется изохорным
Какой процесс называется изохорным, условия протекания
Изохорным процессом называют термодинамический процесс, протекающий при условии постоянного объема.
Изохорный процесс можно наблюдать опытным путем. Для этого необходимо повышать или понижать температуру вещества в газообразном или жидком состоянии, находящегося в сосуде и сохраняющего стабильность объема. В случае, когда манипуляции производят с идеальным газом, его давление и температура будут изменяться прямо пропорционально, согласно закону Шарля. Для реальных газов данная закономерность не применима.
История возникновения теории, кто открыл, формула
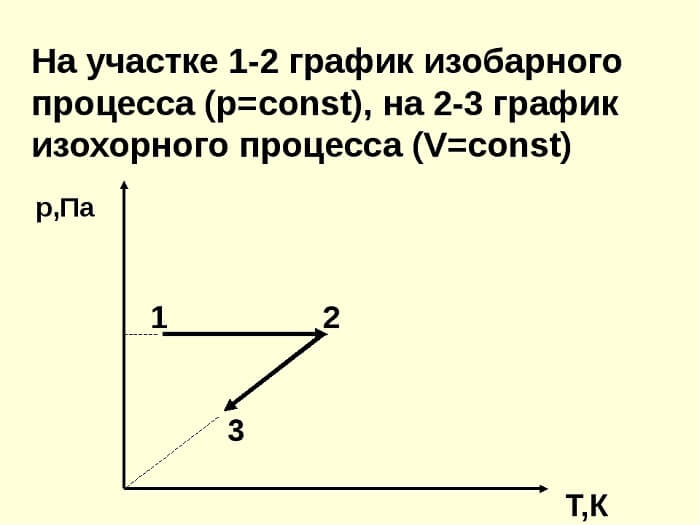
Изучение изохорного процесса связывают с Гийомом Амонтоном. Работа ученого под названием «Парижские мемуары», написанная в 1702 году, посвящена исследованию характеристик газообразного вещества, помещенного в фиксированный объем, который составляет часть «воздушного термометра». Равновесие жидкости в данных условиях объясняется воздействием на нее давления газа, находящегося в сосуде, и атмосферного давления. Если температура среды повышается, показатели давления в резервуаре возрастают. При этом определенный объем жидкости вытесняется в выступающую трубку. Зависимость между такими характеристиками процесса, как температура и давление, представлена на рисунке.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
В 1801 году были опубликованы два эссе исследователя Джона Дальтона с описанием эксперимента, результаты которого демонстрируют одинаковое расширение всех газов и паров при постоянном давлении и изменении температуры, когда начальная и конечная температура одинакова. В итоге был сформулирован закон Гей-Люссака. Ученый, в честь которого явление получило название, экспериментальным путем подтвердил одинаковое расширение различных газообразных веществ и вывел коэффициент, практически равный коэффициенту, полученному Дальтоном. Благодаря объединению данной закономерности с законом Бойля-Мариотта, был описан изохорный процесс.
График изохорного процесса в идеальном газе
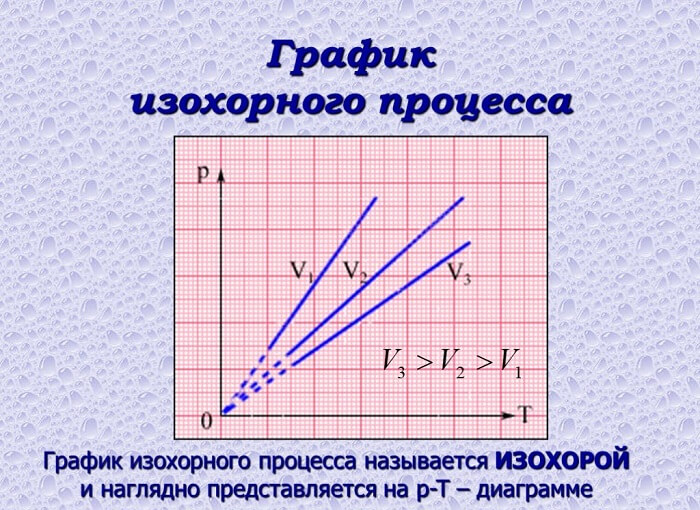
Зависимость характеристик при изохорном процессе можно представить схематично. График на диаграмме в системе координат будет иметь следующий вид:
В случае идеального газа графически изохорные процессы будут изображены следующим образом:
Первый закон термодинамики для изохорного процесса
В условиях термодинамического процесса формула элементарной работы имеет следующий вид:
\(\delta A=PdV\)
Преобразование данного выражения позволит рассчитать величину полной работы процесса:
\(A=\int_{V_{1}}^{V_{1}}{PdV}\)
В случае, когда объем сохраняет стабильность, то есть \(dV=0\), значение интеграла будет нулевым. Исходя из этого, в изохорном процессе работа газа не наблюдается:
\(A=0\)
Изменение внутренней энергии для идеального газа рассчитывается по формуле:
\(\Delta U=\frac{i}{2}\nu R\Delta T\)
где i представляет собой количество степеней свободы, зависящее от числа атомов, которыми обладает молекула газа. В качестве примера можно рассмотреть такие вещества:
- одноатомная молекула неона обладает тремя степенями;
- пять степеней характерно для двухатомной молекулы кислорода;
- в молекуле с тремя и более атомами, как у водяного пара, насчитывается 6 степеней.
Формула внутренней энергии выходит из понятия и уравнения теплоемкости, представляет собой следующее отношение:
\(\Delta U=\nu c_{\upsilon }^{\mu }\Delta T\)
где \(c_{\upsilon }^{\mu }\) является молярной теплоемкостью в условиях постоянного объема.
Расчет количества теплоты выполняют с помощью первого начала термодинамики в условиях термодинамического процесса:
\(Q=\Delta U+A\)
Следует учитывать, что в условиях изохорного процесса газообразное вещество не выполняет работу. Исходя из этого, можно вывести формулу:
\(Q=\Delta U=\nu c_{\upsilon }^{\mu }\Delta T\)
Согласно уравнению, газ получает теплоту. Она полностью расходуется, чтобы изменять внутреннюю энергию газообразного вещества.
Изменения термодинамических параметров в изохорном процессе
В условиях изохорного процесса наблюдается теплообмен с внешней средой. Данное явление называют изменением энтропии. Из его понятия следует уравнение:
\(dS=\frac{\delta Q}{T}\)
где \(\delta Q\) является элементарным количеством теплоты.
Преобразуя уравнение для расчета количества теплоты в дифференциальный вид, получают следующую формулу:
\(\delta Q=\nu c^{\mu }_{\upsilon }dT\)
где \(\nu\) является количеством вещества, а \(\nu c^{\mu }_{\upsilon }\) обозначает молярную теплоемкость в условиях постоянного объема.
Формула микроскопического изменения энтропии в условиях протекания изохорного процесса имеет вид:
\(dS=\frac{\nu c^{\mu }_{\upsilon }dT}{T}dy/dx dy/dx\)
Если проинтегрировать последнюю формулу, то расчет полного изменения энтропии выполняют таким образом:
\(\int_{S_{1}}^{S_{2}}{dS}=\nu \int_{T_{1}}^{T_{2}}\frac{c^{\mu }_{\upsilon }dT}{T}\Rightarrow \Delta S=\nu \int_{T_{1}}^{T_{2}}\frac{c^{\mu }_{\upsilon }dT}{T}\)
В этой ситуации не представляется возможным вынести определение молярной теплоемкости в условиях стабильного объема за интеграл, так как оно представлено в виде функции, зависящей от температуры.
Применение эффекта изохорного процесса
Идеальный цикл Отто приближенно воспроизведен в конструкции мотора внутреннего сгорания, работающего на бензине. Такты 2-3 и 4-1 при его функционировании представляют собой изохорные процессы. На выходе двигателя совершается работа. Она рассчитывается, как разность работ. К одной из них относят работу, производимую газообразным веществом над поршнем в процессе третьего такта или рабочего хода, к другой – работу, затраченную поршнем во время сжатия газа при втором такте. Таким образом, на примере двигателя, функционирующего, согласно принципу Отто, в системе принудительного сжигания смеси, газообразное вещество сжимается до 7-12 раз.
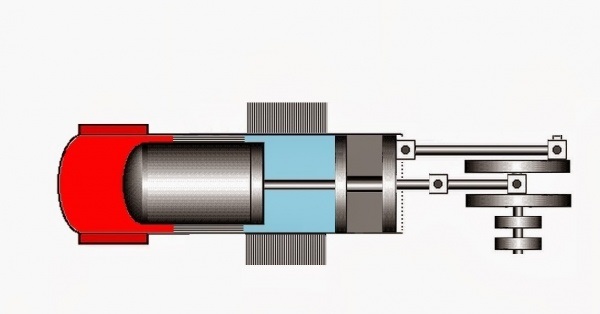
На рисунке изображен классический двигатель Стирлинга с конструкцией бета-типа, для которой характерно расположение рабочего и вытеснительного поршня в одном цилиндре.
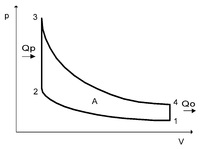
Динамику цикла Отто можно представить в следующем виде:
Цикл Стирлинга также характеризуется наличием двух изохорных тактов. Процесс протекает при дооснащении конструкции двигателя Стирлинга регенератором. Во время прохождения газообразного вещества в одном направлении через наполнитель осуществляется передача тепла от рабочего тела к регенератору. Если газ проходит в обратную сторону, то тепловая энергия передается на рабочее тело. Идеальный цикл Стирлинга достигает обратимости и характеризуется теми же параметрами КПД, что и цикл Карно.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так