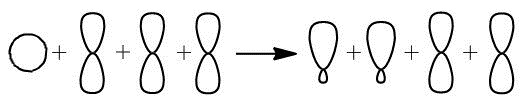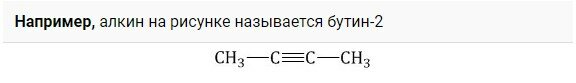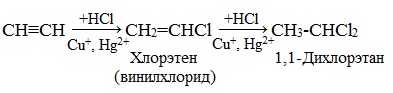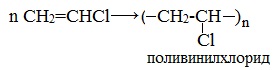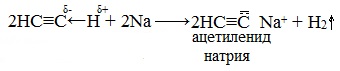Описание химических свойств алкинов
Типичные химические свойства алкинов
Алкины — непредельными (ненасыщенными) нециклическими углеводородами с молекулами, которые характеризуются одной тройной связью между атомами углерода \(С\equiv С\).
Исходя из строения и свойств тройной связи в молекулах непредельных углеродах, можно определить определенные химические свойства алкинов. Они обладают рядом сходств с аналогичными возможностями алкенов. Причиной этому является наличие кратной связи в молекуле. Опытным путем представляется возможным часто наблюдать окисление алкинов, которое преимущественно происходит по тройной связи. Возможны и жесткие варианты окисления такие, как горение.
Строение, изомерия и гомологический ряд алкинов
Гомологи — это алкины, которые обладают схожим строением и могут отличаться одной или несколькими группами \(–СН_2–\).
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Все вещества, относящиеся к группе алкинов, характеризуются одинаковыми или похожими физическими или химическими свойствами. Алкины, представляющие собой гомологи, формируют гомологический ряд.
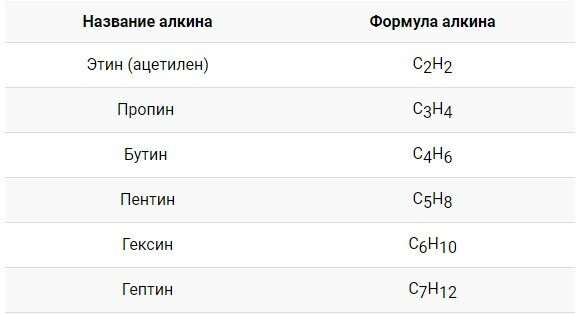
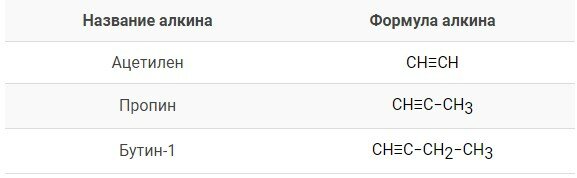
Первым представителем в гомологическом ряду является этин или ацетилен \(C_2H_2\), или \(СH\equiv СH\). Продолжение гомологического ряда происходит путем добавления группы \(–СН_2–\) в углеводородную цепь. На иллюстрации представлен гомологический ряд алкинов.
Общее уравнение гомологического ряда алкинов имеет следующий вид:
\(C_nH_{2n-2}\)
Структура гомологического ряда алкинов следующая:
- в качестве первых трех компонентов используются газы;
- с \(С_5Н_8\) по \(С_{16}Н_{30}\) — жидкости;
- с \(С_{17}Н_{32}\) — твердые вещества.
Особенностью алкинов является плохая растворимость в воде. Вещества хорошо растворяются при контакте с органическими растворителями.
Строение алкинов
Ярким примером таких веществ является ацетилен. На его примере можно рассмотреть строение аклинов. Молекула вещества характеризуется следующими химическими связями:
\(C–H\) и \(С\equiv С\)
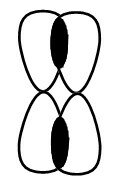
Связь \(C–H\) представляет собой ковалентную слабополярную одинарную σ-связь. Связь \(С\equiv С\) представлена в виде тройной, ковалентной неполярной, одной из связей σ и еще двумя π-связями.
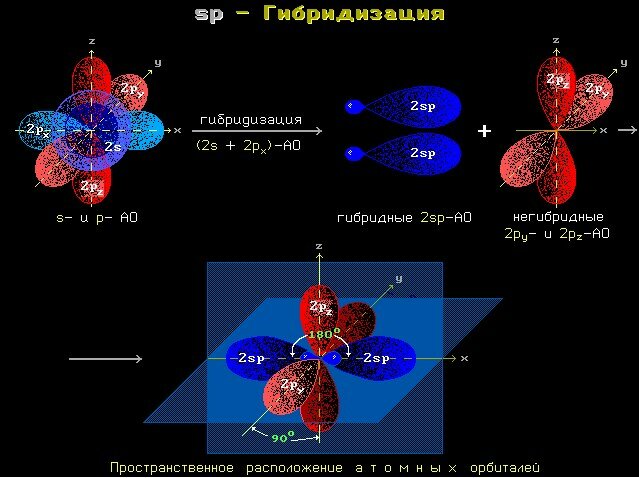
В условиях тройной связи атомы углерода характеризуются образованием двух σ-связей и двух π-связей. Схематично гибридизацию атомов углерода при тройной связи в молекулах алкинов можно представить в виде sp-Гибридизации на рисунке.
Итогом образования σ-связи в атомах углерода является перекрывание sp-гибридных орбиталей атомов углерода. Результат такого преобразования, то есть Cигма-связь, изображен на рисунке.
Когда образуется π-связь между атомами углерода, можно наблюдать перекрывание негибридных орбиталей атомов углерода. В результате получается структура Пи-связи, изображенная на рисунке.
При контакте двух sp-гибридных орбиталей атома углерода можно наблюдать, как они взаимно отталкиваются друг от друга. При этом их положение в пространстве характеризуется максимально возможным углом между орбиталями.
Две гибридные орбитали атомов углерода в условиях тройной связи в алкинах будут располагаться определенным образом. По отношению друг к другу они будут располагаться под углом 180 градусов, что представлено на рисунке.
В результате молекула приобретает линейное строение. Такую структуру можно наблюдать на примере ацетилена \(С_2Н_2\). Модель представлена на рисунке.
Если для молекул алкинов характерно большое число атомов углерода, то им будет соответствовать пространственное строение. К примеру, молекула пропина обладает атомом углерода в sp3-гибридном состоянии, в составе метильного фрагмента \(СН_3\). Данный фрагмент будет иметь тетраэдрическое строение.
Структурная изомерия
Алкины характеризуются следующими типами изомерии:
- углеродный скелет;
- положение кратной связи;
- межклассовая изомерия.
Структурными изомерами называют соединения, обладающие одинаковым составом, но отличающиеся по порядку связывания атомов в молекуле или молекулярным строением.
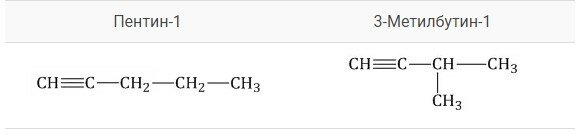
Изомеры углеродного скелета обладают разным строением углеродного скелета. К примеру, можно сравнить Пентин-1 и 3-метилбутин-1, представленные на рисунке.
К межклассовым изомерам относятся вещества, характеризующиеся разными классами и разным строением, но обладающие одинаковым составом. Алкины представляют собой классовые изомеры с алкадиенами. Общей формулой для алкинов и алкадиенов является:
\(C_nH_{2n-2}\)
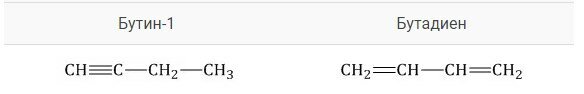
В качестве примера можно привести межклассовые изомеры с формулой \(С_4Н_6\), Бутин-1 и бутадиен-1,3, изображенные на схеме.
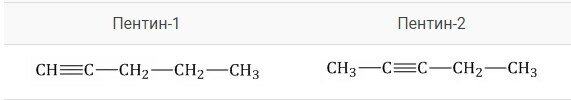
Изомеры могут отличаться по положению тройной связи. В качестве примера можно рассмотреть изомеры с общей формулой \(С_5Н_8\) — пентин-1 и пентин-2, изображенные на рисунке.
Пространственная изомерия
Алкины также характеризуются оптической изомерией. Вещества, имеющие большой углеродный скелет, могут быть представлены в виде оптических изомеров. В этом случае молекула алкина содержит асимметрический атом углерода, который обладает связью с четырьмя разными заместителями.
Номенклатура алкинов
Алкины называются определенным образом, чтобы обозначить тройную связь. Для этого используется суффикс «ин».
Простейшие алкины обладают исторически сложившимися или тривиальными названиями. Такие примеры указаны в иллюстрации.
Тривиальные формулировки также характерны для радикалов с тройными связями. Пример приведен на рисунке.
Реакции электрофильного присоединения
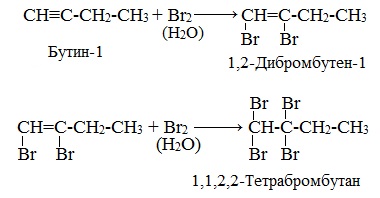
Галогенирование алкинов происходит в два этапа. Во время первой стадии электрофильного присоединения галогенов формируются дигалогеналкены. На втором этапе образуются тетрагалогеналканы. Схематично данные процессы представлены на рисунке.
При реакции алкинов на бромную воду можно наблюдать качественную реакцию на алкины. В результате бромная вода теряет цвет.
Гидрогалогенирование происходит в соответствии с электрофильным механизмом. В процессе к алкинам присоединяются галогеноводороды. Реакция характеризуется двумя стадиями. Второй этап подчиняется правилу Марковникова. Присоединение НCl при отсутствии катализирующего компонента протекает с медленной скоростью. В качестве катализатора такой реакции используются кислоты Льюиса, то есть соли меди (I) и ртути (II).
В результате химической реакции получается хлористый винил или винилхлорид. Вещество характеризуется легкостью полимеризации, аналогично этилену, после чего образуется полимер, называемый поливинилхлоридом. Вещество обладает широкими сферами применения для изготовления поливинилхлоридных смол.
Реакции замещения водородных атомов ацетилена
Алкины с концевой тройной связью, то есть алкины-1, могут проявлять слабые кислотные свойства. Значительная подвижность атомов водорода, которые обладают связями с sp-гибридизированными атомами углерода в молекулах алкинов, объясняется процессом поляризации σ-связи \equiv С─Н. В результате атомы водорода замещаются атомами металлов. Итогом такого преобразования является образование солей — ацетиленидов.
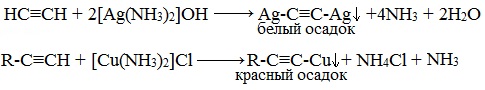
Из ацетиленидов металлов щелочного и щелочноземельного типа получают гомологи ацетилена. Если ацетилен пропустить через аммиачный раствор оксида серебра или хлорида меди, то в результате произойдет образование и выпадение в осадок ацетиленидов серебра и меди.
Осадок металлов образуется в результате качественной реакции на концевую тройную связь. При этом для осадка ацетиленида серебра характерен серо-белый оттенок, а осадок ацетиленида меди обладает красно-коричневым цветом.
В процессе воздействия хлороводородной кислоты на ацетилениды серебра и меди можно наблюдать достаточно простое разложение солей очень слабых кислот, при котором выделяется исходный алкин.
Вещества отличаются по некоторым химическим свойствам. К примеру, ацетилиниды серебра и меди, находящиеся в сухом виде, могут взрываться под действием значительных механических нагрузок. Карбит кальция, который относится к группе ацетиленидов, при ударе достаточно устойчив. Данное вещество активно используется для получения ацетилена. Следует учитывать, что в случае, когда тройная связь не находится на конце цепи, то кислотные свойства в этом случае будут отсутствовать. Если нет подвижного атома водорода, то образование ацетиленидов невозможно.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так