Кардиомиоциты в миокарде — виды и функции
Кардиомиоциты — что это такое, где находятся
Кардиомиоциты (или миокардиоциты) — это клетки, ответственные за выработку сократительной силы в неповрежденном сердце.
Специализированные кардиомиоциты формируют сердечную проводящую систему, ответственную за контроль ритмичного биения сердца. Таким образом, кардиомиоциты — это клетки, из которых состоит сердечная мышца.
Человеческое сердце содержит, по оценкам, 2-3 миллиарда кардиомиоцитов. В сердце есть несколько популяций немиоцитов, включая эндотелиальные клетки, клетки гладкой мускулатуры, миофибробласты, эпикардиальные клетки, эндокардиальные клетки, интерстициальные клетки клапанов, резидентные макрофаги и другие клетки, связанные с иммунной системой, и взрослые «стволовые клетки» (мезенхимальные стволовые клетки и стволовые клетки сердца). Эти отдельные группы клеток не изолированы друг от друга внутри сердца, а физически взаимодействуют для поддержания функции всего органа. В целом, кардиомиоциты составляют менее 1/3 от общего числа клеток в сердце.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Сердце является первым сформированным органом у развивающегося плода. Во время внутриутробного и послеродового развития кардиомиоциты становятся окончательно дифференцированными мышечными клетками, которые соединены сквозными щелевыми соединениями, обеспечивая согласованную сократительную активность. Цикл сокращения-расслабления кардиомиоцитов регулируется циклическим увеличением и уменьшением внутриклеточного Ca2+, инициируемого деполяризацией сарколеммы и поддерживаемого высвобождением и повторным поглощением Ca2+ саркоплазматическим ретикулумом. При стрессе кардиомиоциты подвергаются гипертрофическому росту и апоптотическим реакциям in vivo, а также в моделях клеточной культуры. Такие изменения предрасполагают к сердечной недостаточности в долгосрочной перспективе.
Сарколемма является тонкой, прозрачной, растяжимой мембраной, покрывающей каждое поперечно-полосатое мышечное волокно. Ее структура и дизайн имеют важное значение для получения и проведения стимулов. На каждом конце мышечного волокна наружный слой сарколеммы сталкивается с сухожильными волокнами, которые, в свою очередь, собираются в пучки, образуя мышечные сухожилия.
Кардиомиоциты подвергаются увеличению (гипертрофии) в ответ на хроническую потребность в увеличении сократительной силы, но неспособность удовлетворить эти потребности приводит к недостаточному сердечному выбросу для удовлетворения потребностей всего организма (сердечная недостаточность), одной из наиболее распространенных причин смерти в развитых и развивающихся странах.
Являясь основным типом клеток сердца, сердечные клетки в первую очередь участвуют в сократительной функции сердца, которая обеспечивает перекачку крови по всему телу. У людей, как и у многих других животных, кардиомиоциты являются первыми клетками, которые окончательно дифференцируются, что делает сердце одним из первых органов, формирующихся у развивающегося плода.
Например, в эмбрионе мыши было показано, что клетки-предшественники сердечной мышцы начинают развиваться примерно через 6 дней после оплодотворения. Хотя кардиомиоциты содержат многие органеллы, встречающиеся в клетках других животных, они также содержат другие (например, миофибриллы), которые позволяют им эффективно выполнять свои функции.
Некоторые из основных характеристик кардиоцитов включают:
- Представляют собой удлиненные цилиндрические ячейки и полосатые.
- Большинство кардиомиоцитов имеют одно ядро.
- Имеют сократительные белки.
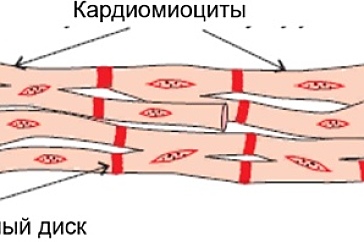
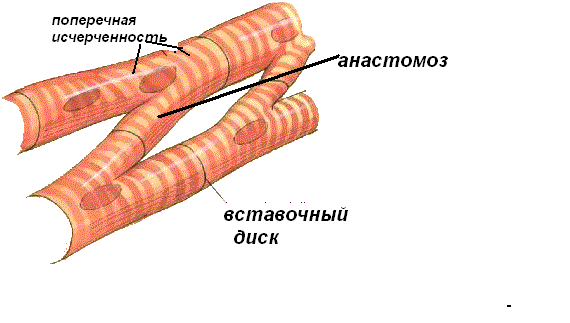
- Кардиомиоциты прикреплены друг к другу через интеркалированные диски.
Расположение кардиоцитов
Клетки сердечной мышцы расположены в параллельных пучках, соединенных друг с другом в областях интеркалированных дисков на концах и по бокам клеток. В целом, ориентация мышечных волокон в субэндокарде левого желудочка вертикальная, идущая от основания к вершине, с параллельными волокнами в папиллярных мышцах и трабекулярных мышцах обоих желудочков.
Последовательно более глубокие слои в левом желудочке от эндокарда ориентированы более горизонтально, с волокнами в области средней стенки примерно под углом 70-90° к волокнам субэндокарда. В субэпикарде волокна повернуты примерно на 120° по сравнению с волокнами в субэндокарде. Таким образом, участок толщиной во всю стенку, разрезанный горизонтально через среднюю часть левого желудочка, будет иметь волокна, ориентированные в поперечном сечении в субэндокарде и субэпикарде, и в продольном сечении в области средней стенки. Продольная ориентация субэндокардиальных волокон в обоих желудочках обычно соответствует линиям кровотока.
Структура кардиомиоцитов
Хотя кардиомиоциты являются мышечными клетками, они отличаются от других мышечных клеток несколькими способами. В отличие от других мышечных клеток в организме, кардиомиоциты обладают высокой устойчивостью к усталости и поэтому всегда сокращаются и расслабляются, чтобы обеспечить правильную циркуляцию крови по всему телу.
Это стало возможным благодаря структурным компонентам ячейки, состоящей из:
- Базальной мембраны.
- Сарколеммы.
- Десмосомы.
- Миофиламенты.
- Митохондрии.
Базальная мембрана миоцитов является границей, отделяющей внутриклеточную часть клетки от внеклеточной среды.
Она состоит из гликопротеинов ламинина и фибронектина, коллагена IV типа, а также протеогликанов, которые способствуют его общей ширине около 50 нм. Мембрана состоит из двух основных слоев, которые включают плотную пластинку и прозрачную пластинку. Обеспечивая непрерывность взаимодействия с внеклеточной средой, базальная мембрана помогает улавливать такие ионы, как кальций, а также действует как барьер, через который происходит обмен различными макромолекулами.
Сарколемма — это специализированная структура, которая также служит внешней оболочкой клетки. Сарколемма состоит из коллагена, гликокаликса (который сжимает базальную мембрану) и плазмалеммы. Поскольку сарколемма состоит из липидного бислоя, она также контролирует тип молекул, которые попадают в клетку. Например, из-за гидрофобного ядра липидного бислоя сарколемма непроницаема для некоторых молекул.
Десмосомы — это щелевые соединения, которые являются частью сарколеммы, представляют собой каналы между соседними волокнами сердечной мышцы.
Эти структуры позволяют деполяризующему току проходить через клетки сердечной мышцы от одной к другой и, таким образом, способствуют сокращению и расслаблению клеток. В отличие от щелевых соединений, десмосомы, также входящие в состав сарколеммы, служат для скрепления концов волокон сердечной мышцы вместе. Это предотвращает разрыв клеток сердечной мышцы во время сокращения. Десмосомы способны выдерживать механические нагрузки, что позволяет им удерживать клетки вместе.
Миофиламенты — это сократительные белки, состоящие из миозина (толстая нить диаметром около 15 нм) и белков актина (тонкие нити диаметром около 7 нм).
В клетке миозин составляет важную группу моторных белков, которые вызывают мышечное сокращение. В кардиомиоцитах миозин II отвечает за сокращение мышц, что позволяет крови перекачиваться по всему телу. Этот тип миозина состоит из двух тяжелых (с моторными головками) и легких цепей. Благодаря энергии, полученной из АТФ, именно головная часть миозина связывается с актином, что приводит к сокращению мышц.
Митохондрия — органелла, которая поддерживает высокий уровень АТФ, необходимый клеткам.
Кардиомиоциты содержат большое количество митохондрий (занимают около 40% клетки). Сердечные мышцы постоянно сокращаются и расслабляются по мере того, как кровь перекачивается по всему телу. Это требует высокого уровня энергии, так как эти мышцы не отдыхают, как в случае с другими типами мышц.
Таким образом, здесь большое количество митохондрий гарантирует, что клетки получают достаточное количество энергии, необходимой для поддержания сердечных сокращений.
Некоторые из других важных органелл, обнаруженных в кардиомиоцитах, включают:
- Альфа-тубулины.
- Бета-тубулины.
- Эндоплазматический ретикулум.
- Ядро.
- Аппарат Гольджи.
Виды кардиомиоцитов, степень их развития
Существует три основных типа кардиомиоцитов:
- Типичные кардиомиоциты — преобладающий тип, функция — сокращение.
- Атипичные кардиомиоциты — без миофибрилл, функция — генерация импульсов и проводимость.
- Секреторные кардиомиоциты — расположенные в правом предсердии, выделяют гормон предсердный натрийуретический фактор, который вызывает потерю натрия и воды, снижая кровяное давление.
Выделяют также четвертый тип — промежуточный.
Функции кардиомиоцитов
- Механизм сокращения является одним из главных механизмов данных клеток.
- Обновление кардиомиоцитов.
Хотя считалось, что регенерация клеток сердечной мышцы отсутствует, исследования показали, что эти клетки обновляются со значительно низкой скоростью на протяжении всей жизни человека. Например, для молодых людей, в возрасте около 25 лет, годовой оборот кардиомиоцитов, как говорят, составляет около 1%. Этот показатель, однако, снижается примерно до 0,45% для пожилых людей (75 лет и старше).
В течение жизни человека обновляется менее 50% этих клеток, что показывает, что по сравнению со многими другими клетками кардиомиоциты имеют очень длительный срок службы.
В случае травм или инфаркта миокарда набираются моноциты для удаления любых поврежденных/некротизированных кардиомиоцитов. Было высказано предположение, что фагоцитоз этими клетками является одной из предпосылок восстановления сердца.
3. Регенерация кардиомиоцитов.
В отличие от некоторых животных, таких как рыбки Данио, поврежденные сердечные мышцы людей не восстанавливаются в достаточной степени, чтобы позволить сердцу исцелиться самостоятельно. По этой причине у большинства людей, которые испытывают различные травмы сердца, а также сердечные приступы (которые поражают кардиомиоциты), в результате развивается сердечная недостаточность, которая может привести к смерти.
Эта способность, согласно исследованиям, теряется примерно через неделю жизни, что означает невозможность регенерации сердца у людей. Из-за неспособности сердечной мышцы к регенерации имплантация механических желудочковых устройств и трансплантация сердца по большей части были единственным решением.
Хотя сердечные клетки неспособны к регенерации (достаточно быстро, чтобы восстанавливать повреждения / травмы), исследования показали, что клетки-предшественники у взрослых способны производить новые клетки. Эти клетки, известные как сердечные стволовые клетки, находятся в сердце, и усилия были направлены на их изоляцию.
Развитие кардиомиоцитов
Во время развития сердце растет путем дифференцировки пролиферирующих (разрастающихся) мультипотентных клеток-предшественников сердца в кардиомиоциты и контролируемой локальной пролиферации уже дифференцированных кардиомиоцитов. Этот процесс требует жесткой регуляции уровней внеклеточных факторов роста, а также внутриклеточной экспрессии факторов транскрипции.
Большая часть знаний о развитии сердца была получена в результате исследований трансгенных эмбрионов мышей и гистологических 3D-реконструкций. Однако в других исследованиях использовались МРТ и флуоресцентные изображения для сравнения развития сердца у мышей и людей. Из этих исследований можно было бы продемонстрировать, что последовательность событий в развитии сердца сопоставима у обоих видов, что делает мышь полезной моделью для экстраполяции на изучение развития сердца человека.
Формирование сердца начинается на 3-й неделе эмбрионального развития человека, что соответствует эмбриональному дню 7,5 развития мыши. На этой стадии эмбрион состоит из трех зародышевых слоев: энтодермы, мезодермы и эктодермы. Большая часть сердечной ткани будет происходить из мезодермы. Во время гаструляции ранние клетки-предшественники сердца располагаются в двусторонних областях средней линии эмбриона. Когда эмбрион складывается, эти области, образующие сердце, сливаются по средней линии, образуя то, что обычно называют сердечным полумесяцем. Клетки сердечного полумесяца демонстрируют профиль экспрессии кардиогенных генов, инициируют переходные процессы кальция и вскоре после этого начинают биться.
Типичные (рабочие, сократительные) кардиомиоциты
Сердечные клетки в первую очередь участвуют в сократительной функции сердца, которая обеспечивает перекачку крови по всему телу.
Кардиомиоциты проходят цикл сокращения-расслабления, который позволяет сердечным мышцам перекачивать кровь по всему телу. Это достигается с помощью процесса, известного как связь возбуждения и сокращения, который преобразует потенциал действия (электрический стимул) в мышечное сокращение.
Механизм сокращения
Во время потенциала действия деполяризация мембраны приводит к притоку ионов кальция в клетку. Поскольку кальций связывается с рецепторами внутри клетки, это приводит к высвобождению еще большего количества кальция в клетку (через кальциевые каналы в Т-канальцах). В свою очередь, это приводит к укорочению актин-миозиновых фибрилл в клетке и, следовательно, к общему сокращению клетки.
Этот процесс может быть представлен следующими шагами:
- Потенциал действия индуцируется клетками кардиостимулятора (в синоатриальных и атриовентрикулярных узлах) и сначала передается кардиомиоцитам через щелевые соединения (вставленные диски).
- Кальциевые каналы в Т-канальцах активируются потенциалом действия, когда он проходит между саркомерами миофибриллы, высвобождая ионы кальция в клетку.
- В цитоплазме кардиомиоцитов кальций связывается с сердечным тропонином-С, который, в свою очередь, перемещает тропониновый комплекс из места связывания актина. В результате актин может свободно связывать миозин, тем самым инициируя сокращение.
- Когда миозин связывается с молекулой АТФ, нити актина притягиваются к центральной части саркомера, что заставляет мышцу сокращаться.
- В фазе реполяризации кальций удаляется из цитоплазмы клетки (из цитозоля в саркоплазматический ретикулум или внеклеточную жидкость). Это позволяет комплексу тропонина вернуться в исходное положение, что, в свою очередь, прекращает сокращение.
Проводящие (атипичные) кардиомиоциты
По сравнению с сократительными сердечными миоцитами проводящий миоцит отличается:
- меньше миофибрилл; тем не менее, было замечено, что проводящие клетки сокращают больший объем клетки, занимаемый цитоплазмой, более сферической, а центральное ядро;
- содержит больше гликогена внутри клетки.
Кроме того, клетки проводящей системы могут проявлять тесную связь с нервными клетками. Это связь с вегетативной нервной системой, которая регулирует активность миоцитов, например, скорость проводимости.
Секреторные кардиомиоциты
Эндокринные (или секреторные) сердечные миоциты имеют не только хорошо развитые сократительные структуры, такие как миоциты желудочков, но и электронно-плотные гранулы в саркоплазме. Изучая морфологию сердца под влиянием различных факторов, исследователи сосредотачиваются на миокарде левого желудочка. Общепризнано, что ключевая роль в развитии многочисленных сердечных патологий отводится сократительным миоцитам желудочков. Роли предсердий уделяется меньше внимания, чем желудочкам, но их расширение определяет развитие хронической сердечной недостаточности и аритмии.
Промежуточные (переходные) проводящие кардиомиоциты
Промежуточные (переходные) кардиомиоциты предсердно-желудочкового узла передают возбуждение на рабочие кардиомиоциты, а также на третий вид атипичных кардиомиоцитов — клетки-волокна Пуркинье. Переходные кардиомиоциты также способны самостоятельно генерировать электрические импульсы, однако их частота ниже, чем частота импульсов, генерируемых пейсмекерными клетками, и оставляет 30-40 в минут.
Потенциал действия рабочего кардиомиоцита
Хотя сердечные миоциты разветвляются и соединяются друг с другом (механически через вставленный диск и электрически через щелевые соединения), при нормальных условиях следует рассматривать сердце как две отдельные функциональные сети миоцитов: предсердия и желудочки. Это происходит из-за разделения тканей предсердий и желудочков волокнистым скелетом сердца (центральным волокнистым телом). Этот скелет состоит из плотных колец соединительной ткани, которые окружают клапаны сердца, сливаются друг с другом, а также сливаются с межжелудочковой перегородкой.
Можно предположить, что эта волокнистая структура:
- образует основу, к которой прикрепляются клапаны;
- предотвращает чрезмерное растяжение клапанов;
- служит точкой вставки для пучков сердечной мышцы;
- действует как электрический изолятор, который предотвращает прямое распространение потенциала действия от предсердий к желудочкам (нормальное распространение происходит через пучок его).
Здоровая клетка миокарда имеет мембранный потенциал покоя приблизительно ~90 мВ. Этот потенциал покоя может быть описан уравнением Голдмана-Ходжкина-Каца, которое учитывает проницаемость (P), а также внутриклеточную и внеклеточную концентрацию ионов [X], где X — ион.
\(Vm = (2,3 R*T/F)*log10 PK[K]o + PNa[Na]o + PCl[Cl]i + PCa[Ca]o + ...PK[K]i + PNa[Na]i + PCl[Cl]o + PCa[Ca]i + ...\)
В сердечном миоците мембранный потенциал определяется равновесным потенциалом K+. Потенциал действия инициируется, когда этот потенциал покоя смещается в сторону более положительного значения примерно от ~60 до ~70 мВ. При этом пороговом потенциале Na+- каналы, управляемые напряжением, открываются и запускают каскад событий, вовлекающих другие ионные каналы. При искусственной электрической стимуляции этот сдвиг потенциала покоя и последующая деполяризация вызываются возбуждением, подаваемым через систему стимуляции. Типичные концентрации ионов для миоцитов сердца млекопитающих приведены в таблице.
| Ион | Внутриклеточная концентрация (мм) | Внеклеточная концентрация (мм) |
| Натрий (Na+) | 5-34 | 140 |
| Калий (K+) | 104-180 | 5,4 |
| Хлорид (Cl-) | 4,2 | 117 |
| Кальций (2+) | 10-7 | 3 |
Когда потенциал миоцита доводится до порогового значения, обычно посредством передаваемой активации из соседней клетки, активно открываются быстрые Na+-каналы, управляемые напряжением (ворота активации); проницаемость сарколеммы (плазматической мембраны) для ионов натрия (PNA+) резко возрастает. Поскольку цитозоль электрически более отрицателен, чем внеклеточная жидкость, а концентрация Na+ во внеклеточной жидкости выше, Na+ быстро проникает через клеточную мембрану. Важно отметить, что в течение нескольких миллисекунд эти быстрые Na+-каналы автоматически инактивируются (через вентили инактивации), а PNA + уменьшается.
Деполяризация мембраны вследствие активации Na+ индуцирует открытие управляемых напряжением медленных каналов Ca2+, расположенных как в сарколемме, так и в саркоплазматическом ретикулуме (внутреннем хранилище Ca2+). Таким образом, происходит увеличение проницаемости Ca2+ (Pca2+), что позволяет концентрации резко увеличиваться внутриклеточно. В то же время проницаемость мембраны для ионов K+ снижается из-за закрытия K+-каналов. В течение примерно 200-250 мс мембранный потенциал остается близким к 0 мВ (т.е. деполяризованным относительно состояния покоя), поскольку небольшой отток K + просто уравновешивает приток Ca2+.
После этой довольно длительной задержки открываются K+-каналы, управляемые напряжением, и инициируется активная реполяризация. Открытие этих каналов K+ (повышенная проницаемость мембраны) позволяет K+ диффундировать из клетки благодаря градиенту его концентрации. В это же время каналы Ca2+ начинают закрываться, и в движении суммарного заряда преобладает поток положительно заряженного K+, восстанавливающий отрицательный мембранный потенциал покоя примерно до ~ 90 мВ.
Как упоминалось выше, не все потенциалы действия, которые возникают в миокарде сердца, имеют одинаковые временные интервалы. Более конкретно, ячейки с медленным и быстрым откликом имеют разную форму потенциалов действия с различными электрическими свойствами в каждой фазе.
Клетки кардиостимулятора (тип медленной реакции) обладают способностью самопроизвольно деполяризовываться (нестабильный потенциал покоя) до тех пор, пока они не достигнут порога, а затем не вызовут потенциалы действия. Потенциалы действия от таких клеток также характеризуются более медленной начальной фазой деполяризации, меньшим превышением амплитуды, более короткой и менее стабильной фазой плато и реполяризацией до нестабильного, медленно деполяризующегося потенциала покоя.
В клетках кардиостимулятора, по крайней мере, три механизма, как полагают, лежат в основе медленной деполяризации, которая происходит во время фазы 4 (диастолический интервал): 1) прогрессирующее снижение PK+; 2) небольшое увеличение PNA+; и 3) увеличение PCA2+.
Кардиомиоциты при различных заболеваниях сердечно-сосудистой системы
Сердечно-сосудистые заболевания являются ведущей причиной смерти во всем мире. Почти 2400 американцев умирают от сердечных заболеваний каждый день, одна смерть каждые 37 секунд. В России в год от сердечно-сосудистых заболеваний умирает миллион человек.
Являясь основным типом клеток сердца, клетки сердечной мышцы в первую очередь отвечают за сократительную функцию сердца и обеспечивают перекачку крови по всему телу. Если что-то пойдет не так в сердце, это может привести к катастрофическому исходу. Инфаркт миокарда (ИМ), широко известный как сердечный приступ, возникает, когда прекращается приток крови к части сердца, вызывая массивную гибель кардиомиоцитов в этой области. Тяжелые случаи могут, в конечном счете, привести к сердечной недостаточности и смерти.
Прогрессирование инфаркта миокарда или сердечного приступа. Во время послеинфаркта:
0-12 часов: Начало некротической коагуляции из–за закупорки коронарных артерий — кардиомиоциты страдают от недостатка кислорода (гипоксия)
12-72 часа: Кульминация некротической коагуляции — инфильтрация нейтрофилами в результате воспалительной реакции.
1-3 недели: Распад погибших миоцитов и образование грануляционной ткани (коллагеновых волокон, макрофагов и фибробластов).
> 1 месяца: Образование фиброзного рубца (меньшее количество клеток с обилием коллагеновых волокон).
Факты о кардиомицитах при сердечных заболеваниях:
- Стимуляция обновления кардиомиоцитов представляет собой основной терапевтический подход к регенерации сердца.
- Механизмы развития, контролирующие пролиферацию кардиомиоцитов, представляют собой потенциальные мишени для регенерации сердца.
- Высвобождение блока Hippo является важной контрольной точкой, позволяющей кардиомиоцитам вернуться в клеточный цикл.
Сердечные заболевания, характеризующиеся потерей кардиомиоцитов, приводят к резкому нарушению сердечной функции и, в конечном счете, к застойной сердечной недостаточности. Несмотря на значительные достижения, традиционные методы лечения не исправляют дефекты в количестве клеток сердечной мышцы, и прогноз застойной сердечной недостаточности остается плохим.
Существование в сердце взрослого млекопитающего низкой, но обнаруживаемой способности кардиомиоцитов к пролиферации сместило цель регенеративной терапии в сторону новой терапевтической стратегии. Действительно, стимуляция пролиферации терминально дифференцированных кардиомиоцитов представляет собой основной терапевтический подход к регенерации сердца. Все больше доказательств того, что потеря потенциала обновления кардиомиоцитов млекопитающих вскоре после рождения приводит к потере регенеративных способностей, убедительно подтверждают гипотезу о том, что подробное понимание молекулярных механизмов, контролирующих пролиферацию кардиомиоцитов плода и после рождения, имеет важное значение для определения целей для регенерации сердца.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так