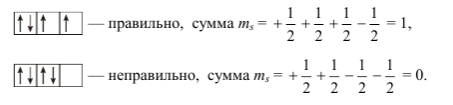Характеристика многоэлектронного атома
Что такое многоэлектронные атомы
Многоэлектронные атомы представляют собой такие атомы, для которых характерно наличие свыше одного электрона на электронных оболочках.
Рассматриваемый вид структур имеет ряд отличий от одноэлектронных атомов. Разница между озвученными понятиями заключается в том, что второй вариант строения подразумевает присутствие всех отрицательно заряженных частиц на единой электронной оболочке. В случае многоэлектронного атома предусмотрено более одной оболочки с электронами.
Строение
Какая-либо из оболочек с электронами в составе атома изучаемого типа обладает энергетическим запасом и различным числом частиц с отрицательным зарядом. Данные структуры размещены около атомного ядра. С целью идентификации таких образований используют цифры в диапазоне от 1 до 7. При этом за единицу принимают наиболее близкую к центру оболочку, а седьмая расположена на максимально допустимом удалении от ядра.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
В составе любой электронной оболочки можно наблюдать присутствие подоболочки. При обозначении данных образований используют буквы s, p, d, f и другие. Подобные объекты характеризуются специфической формой и включают в себя неодинаковое число электронов. К примеру, предусмотрены следующие лимиты на количество отрицательно заряженных частиц в зависимости от расположения подоболочки:
- s — до 2 электронов;
- p — до 6 электронов;
- d — не более 10 электронов.
Принцип Паули
Ограничение, которое сформулирован Вольфганг Паули, распространяет свое действие на предельно допустимое количество отрицательно заряженных частиц в атоме. Согласно данному утверждению, максимальное значение такого числа соответствует двум. При этом рассматриваемые электроны обладают антипараллельными спинами. Исходя из озвученного положения, допустимы следующие схемы заполнения атомных орбиталей:
Источник: in.lit.msu.ru
Правило Гунда
Следующая закономерность предусматривает формулировку принципа и последовательности размещения элементов в виде электронов на подуровнях атомных орбиталей. Исходя из представленного правила, расположение реализовано таким образом, что достигается наибольшее значение спинового числа в сумме. Параметр обозначают \(\sum m_{s}. \) В процессе расстановки отрицательно заряженных частиц на каком-либо подуровне, например, р-подуровне, необходимо предусмотреть для каждого электрона отдельную орбиталь. По итогам заполнения всех имеющихся орбиталей происходит переход для размещения на них вторых электронов. Рассмотрим наглядную схему реализации описанного процесса:
Источник: in.lit.msu.ru
Распределение электронов в многоэлектронных атомах
Размещение частиц с отрицательным зарядом в структуре атома в соответствии с уровнями и орбиталями регламентировано ранее рассмотренными принципами Паули и Хунда. На особенности распределения электронов влияет механизм наименьших энергий. В случае многоэлектронного атома на частицы с зарядом, имеющим знак минуса, воздействуют несколько сил:
- притяжение атомным ядром, для которого характерен положительный заряд;
- отталкивание ближайшими электронами.
Отрицательные частицы, расположенные на внутренних уровнях в структуре атома, снижают силу притяжения внешнего электрона ядром. Таким образом, формируется своеобразный экран между ядром и дальним электроном. Характеристики рассматриваемого состояния экранирования определяются в зависимости от формы электронного облака. По этой причине существует зависимость между энергией электрона и величинами главного квантового числа и орбитального квантового числа, определяющего конфигурацию электронной орбитали.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так