Распределение Больцмана
Что такое распределение Больцмана
Распределением Больцмана называют распределение вероятностей разных энергетических состояний идеальной термической системы, включая идеальный газ атомов или молекул, при термодинамическом равновесии.
Данная закономерность объясняет принцип деления частиц, которые находятся под воздействием силового поля, при условии теплового равновесия. Принцип описан Л. Больцманом в 1868 – 1871 гг.
Австрийский физик-теоретик Больцман Людвиг является одним из основоположников классической статистической физики. Основные утверждения ученого связаны с кинетической теорией газов, термодинамикой и теорией излучения. Больцман представил кинетическую формулу газов, которая легла в основу физической кинетики, а также первым использовал и применил к излучению термодинамические закономерности.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Исходя из распределения Больцмана, можно рассчитать количество частиц с полной энергией \(E_{i}\) в среднем:
\(\\left =\frac{1}{Z}e^{-\frac{E_{i}}{k_{B}t}}N_{i}\)
где \(N_{i}\) является переменной кратностью состояния частицы с энергией \(E_{i}\) или числом возможных состояний частицы с энергией \(E_{i}\).
Постоянная Z рассчитывается с условием, что сумма \(n_{i}\) со всеми возможными значениями i составляет заданное полное количество частиц n в системе, что является условием применения для нормировки:
\(\sum_{i}^{}{n_{i}}=n\)
При условии, что частицы перемещаются, согласно пояснению принципов классической механики, энергия \(E_{i}\) состоит из следующих компонентов:
- Кинетическая энергия \(E^{1}_{i}=E_{i}\) (кин) частицы в виде молекулы или атома.
- Внутренняя энергия \(E^{2}_{i}=E_{i}\) (вн), к примеру, энергия возбуждения электронов.
- Потенциальная энергия \(E^{2}_{i}=E_{i}\) (пот), характерная для внешнего поля, которая определяется положением частицы в пространстве.
\(E_{i}= E^{1}_{i}+ E^{2}_{i}+ E^{3}_{i}\)
Распределение Больцмана в поле сил тяжести
Можно рассмотреть нахождение идеального газа в поле, в котором действуют консервативные силы, с тепловым равновесием. В зависимости от точек с разными значениями потенциальной энергии определяется концентрация газа, что позволяет соблюсти условия механического равновесия. Количество молекул на единицу объема n уменьшается во время удаления от поверхности Земли, и величина давления убывает, исходя из уравнения:
\(P\;=\;nkT\)
Когда определено количество молекул в единице объема, можно найти и величину давления. Справедлив и обратный принцип выполнения расчета числа молекул в определенном объеме при известном давлении. Плотность среды и параметры давления находятся в пропорциональной зависимости друг от друга, в условиях стабильных температурных показателей. Рост величины давления с уменьшением высоты объясняется тем, что на нижний слой оказывается нагрузка в виде веса всех атомов, которые находятся выше этого уровня.
Согласно основному уравнению молекулярно-кинетической теории можно P заменить на n для барометрической формулы и получить, таким образом, распределение Больцмана для молярной массы газа:
\(n=n_{0}e^{-\frac{\mu gh}{RT}}\)
Где n является количеством молекул в единице объема на высоте h = 0 и h.
Согласно уравнению:
\(\mu =mN_{a}\)
и формуле:
\(R=N_{a}k\)
распределение Больцмана имеет следующий вид:
\(n=n_{0}e^{-\frac{mgh}{kT}}\)
Количество молекул на высоте, не равной нулю, уменьшается при понижении температуры. Если Т = 0, нельзя наблюдать тепловое движение. В этом случае все молекулы были бы распределены на поверхности Земли. Высокая температура, наоборот, способствуют практически равномерному распределению молекул по высоте. При этом показатели плотности молекул медленно уменьшаются с высотой. Исходя из уравнения потенциальной энергии:
\(U = mgh\)
в зависимости от высоты U будет отличаться. Таким образом, равенство:
\(n=n_{0}e^{-\frac{mgh}{kT}}\)
является характеристикой распределения частиц, согласно величине потенциальной энергии:
\(n=n_{0}e^{-\frac{U}{kT}}\)
Данное уравнение является законом распределения частиц, согласно потенциальным энергиям, или распределением Больцмана. В этом случае \(n_{0}\) представляет собой количество молекул на единицу объема там, где U = 0.
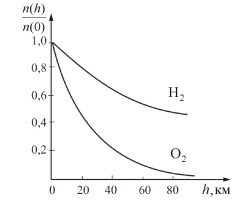
Наглядно продемонстрировать зависимость концентрации разных газообразных веществ от высоты можно с помощью графика. Таким образом, количество более тяжелых молекул во время увеличения высоты уменьшается быстрее, чем легких.
Исходя из выведенной формулы, отношение концентраций молекул в точках с \(U_{1}\) и \(i>U_{2}\) будет записано в таком виде:
\(\frac{n_{1}}{n_{2}}=e^{-\frac{U_{1}-U_{2}}{kT}}\)
Больцманом было доказано, что данная формула справедлива и для потенциального поля с силами гравитации, и для любого потенциального поля с совокупностью каких-либо одинаковых частиц, которые совершают хаотичное тепловое движение.
Барометрическая формула Больцмана, вывод
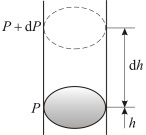
На какой-то высоте h можно наблюдать атмосферное давление, наличие которого объясняется весом слоев газа, находящихся выше этого уровня. Можно представить, что Р является давлением на высоте h, а P + dP характерно для h + dh.
Следует отметить, что dh > 0, а dP < 0, так как для больших высот характерно меньшее давление. Разность давления P – (P + dP) соизмерима с весом газа, который заключен в объеме цилиндра, площадь основания которого составляет единицу, а высота равна dh. Так как:
\(P=\rho gh\)
где \(\rho =\frac{P\mu }{RT}\) является плотностью газа на высоте h, постепенно уменьшающейся с высотой. Согласно этому, можно представить следующее равенство:
\(P-\left(P+dP \right)=\rho gdh\)
Исходя из этого равенства, можно записать барометрическое уравнение, которое будет иметь следующий вид:
\(P=P_{0}e^{-\frac{mgh}{RT}}\)
где \(P_{0}\) является величиной давления на высоте h = 0.
Правила построения графика
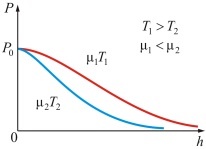
Согласно выведенной закономерности, можно заметить, что скорость убывания Р тем больше, чем выше масса газа или больше μ и чем ниже показатели температуры. В качестве практического примера можно рассмотреть концентрацию легких газообразных веществ таких, как Не и Н2, которая на большой высоте существенно больше, чем у земной поверхности.
Графически закономерность можно изобразить с помощью двух кривых, которые трактуются, либо как соответствующие разным μ (при одинаковой Т), либо как отвечающие разным Т, при одинаковых μ. На графике видно, чем тяжелее газ (больше μ) и чем ниже температура, тем быстрее убывает давление.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так