Алканы: свойства, получение, применение
Что такое алканы
Алканы представляют собой предельные углеводороды, имеющие лишь одинарные взаимосвязи, объединяющие атомы С-С в молекуле. Таким образом, объем водорода в этом случае соответствует максимальным значениям.
Изобразить химическую структуру вещества можно с помощью следующей схемы:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Источник: ru.wikipedia.org
При исследовании алкановых молекул можно обнаружить химические взаимосвязи С-Н и С-С. В первом случае допустимо говорить о слабой полярности ковалентной связи. Следующая связь С-С является ковалентной и неполярной. Перечисленные взаимосвязи определяются как одинарные \(\sigma–связи\). С помощью углеродных атомов в веществе формируется по две пары \(\sigma–связи\). В результате формируется следующая схема гибридизации углеродных атомов в алкановых молекулах — \(sp^{3}\). Изобразить ее можно таким способом:
Источник: chemege.ru
В процессе формирования связи С-С наблюдается перекрытие \(sp^{3}-гибридных\) орбиталей углеродных атомов. Происходит это таким образом:
Источник: chemege.ru
Образование взаимосвязи С-Н сопровождается перекрытием \(sp^{3}-гибридной\) орбитали углеродного атома и s-орбитали водородного атома. Изобразить этот процесс наглядно можно с помощью схемы:
Источник: chemege.ru
Анализ \(sp^{3}-гибридных\) орбиталей углеродного атома позволяет выявить их отталкивание относительно друг друга. Рассматриваемые орбитали расположены по отношению к друг другу под самым большим из всех вероятных углов. По этой причине угол между гибридными орбиталями, которых две пары в углеродном атоме в алканах, соответствует 109 градусам и 28 минутам. Наглядно положение изображено на схеме ниже:
Источник: chemege.ru
Исходя из вышесказанного, следует сделать вывод о том, что молекула построена в форме тетраэдра.
Химические свойства
Известно, что алканы являются предельными углеводородами. Исходя из этого, реакции присоединения с их участием невозможны. Виды химического взаимодействия, в которые вступают алканы:
- разложение;
- замещение;
- окисление.
Связи со слабой степенью полярности С-Н разрываются, когда реализован гомолитический механизм. Реакция сопровождается формированием свободных радикалов. По этой причине для алканов типичны исключительно радикальные реакции. Известно об устойчивости рассматриваемых веществ к воздействию соединений с сильными окислительными свойствами, к примеру, \(KMnO_{4} и K_{2}Cr2_{2}O_{7}\). Кроме того, исключено взаимодействие алканов со следующими соединениями:
- концентрированные кислоты;
- щелочи;
- бромная вода.
Галогенирование алканов реализовано по радикальной схеме. Взаимодействие в составе из алканов и галогена можно наблюдать в процессе повышения температуры или воздействия ультрафиолетового излучения. Процесс состоит из нескольких последовательных стадий, в рамках которых происходит замещение лишь одного водородного атома:
\({\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}\)
\({\mathsf {CH_{3}Cl+Cl_{2}\rightarrow CH_{2}Cl_{2}+HCl}}\)
\({\mathsf {CH_{2}Cl_{2}+Cl_{2}\rightarrow CHCl_{3}+HCl}}\)
\({\mathsf {CHCl_{3}+Cl_{2}\rightarrow CCl_{4}+HCl}}\)
Галогенирование реализовано по цепочке:
- Инициирование. \({\displaystyle {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}\).
- Увеличение цепи. \({\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+HCl}}}. {\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{:}}Cl\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}+Cl{\text{·}}}}}\)
- Обрывание цепочки. \({\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}}}}\).
В случае реакции бромирования алканов наблюдается повышенная стереоселективность. Иодирование алканов с помощью йода не реализовано. Синтез иодидов не представляется возможным осуществить путем прямого иодирования. При взаимодействии алканов с фтором и хлором повышается вероятность возникновения взрывоопасной ситуации. По этой причине принято смешивать галоген с азотом или растворителем, который подходит для конкретного случая.
В результате химической реакции сульфирования алканов образуются алкилсульфокислоты:
\({\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}{\xrightarrow {O_{2};SO_{2};h\nu }}CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}SO_{2}OH}}}\)
Реакцию сульфохлорирования называют реакцией Рида. Описать процесс взаимодействия можно следующим образом:
Источник: ru.wikipedia.org
Цепной процесс развивается по такой схеме:
- \(\mathsf{RH + Cl \cdot \rightarrow R\cdot + HCl}\)
- \(\mathsf{R\cdot + SO_2 \rightarrow RSO_2\cdot}\)
- \(\mathsf{RSO_2\cdot + Cl_2 \rightarrow RSO_2Cl + Cl\cdot}\)
Нитрование заключается в реакции алканов с 10% составом растворенной азотной кислоты или оксидом азота \(NO_{2}\) в газообразном агрегатном состоянии. Температурный режим при этом устанавливают в 140 °C, а давление поддерживают на небольших параметрах. Химический процесс сопровождается формированием нитропроизводных:
\(\mathsf{RH + HNO_3 \rightarrow RNO_2 + H_2O}\)
Окислительные процессы с участием алканов в виде жидкости реализованы по свободно-радикальному принципу. В результате химического взаимодействия формируются гидропероксиды, продукты их разложения и реакции с начальным алканом. Схематично ключевую реакцию автоматического окисления можно представить следующим образом:
\(\mathsf{RH + O_2 \rightarrow R\cdot + HOO\cdot}\)
\(\mathsf{R\cdot + O_2 \rightarrow ROO\cdot}\)
\(\mathsf{ROO\cdot + RH \rightarrow ROOH + R\cdot}\)
Предельные углеводороды применяют в качестве горючего. Это возможно за счет участия веществ в реакциях горения. Для примера целесообразно рассмотреть такое химическое взаимодействие:
\(\mathsf{CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O + \Delta Q}\)
Величина Q может составлять от 46 тыс. до 50 тыс. кДж/кг.
Продуктами химических реакций каталитического окисления алканов являются:
- спирты;
- альдегиды;
- карбоновые кислоты.
В процессе мягкого окисления \(CH_{4}\) кислородом с условием наличия катализатора и при нагреве до 200 °C вероятно формирование следующих веществ:
- метанол: \(\mathsf{2CH_4 + O_2 \rightarrow 2CH_3OH}\)
- формальдегид: \({\mathsf {CH_{4}+O_{2}\rightarrow HCHO+H_{2}O}}\)
- муравьиная кислота: \(\mathsf{2CH_4 + 3O_2 \rightarrow 2HCOOH + 2H_2O}\)
Физические свойства
Алканы плавятся и кипят при температурном режиме, который повышается по мере увеличения их молекулярной массы и протяженности ключевой углеродной цепи. Алканы характеризуются следующими агрегатными состояниями:
- газы с \(CH_{4} до C_{4}H_{10}\);
- жидкости с \(C_{5}H_{12} до C_{13}H_{28}\);
- твердые материалы с \(C_{14}H_{30}\).
При исследовании разных видов алканов можно наблюдать снижение величины температуры, при которой вещества плавятся и кипят, по мере увеличения степени разветвленности. Алканы в состоянии газа или твердого вещества не имеют запаха. В определенных случаях жидкости характеризуются специфичным «бензиновым» запахом.
Алканы не обладают какой-либо окраской. Вес веществ меньше по сравнению с водой. В водной среде алканы не растворяются, но демонстрируют хорошую растворимость в органических растворителях. Алканы в жидком агрегатном состоянии, к примеру, пентан и гексан, могут играть роль растворителей в химических реакциях.
Получение: формула
Алканы, как и прочие разновидности углеводородов, получают из нефти и природного газа. Как правило, залежи сырьевых материалов расположены в одном месте. Существует несколько основных способов лабораторного синтеза алканов:
- Взаимодействие галогеналканов с металлическим натрием, то есть реакция Вюрца: \(\mathsf{2R\text{-}Br + 2Na \rightarrow R\text{-}R + 2NaBr}\)
- Электролиз солей карбоновых кислот, то есть синтез Кольбе: \(\mathsf{CH_3COO^- \rightarrow CH_3COO\cdot + e^-}\)
- \(\mathsf{CH_3COO\cdot \rightarrow CH_3\cdot + CO_2}\)
- \(\mathsf{2CH_3\cdot + B \rightarrow C_2H_6}\)
- Декарбоксилирование солей карбоновых кислот, то есть реакция Дюма: \({\displaystyle CH{\scriptstyle {\text{3}}}COONa+NaOH\rightarrow Na{\scriptstyle {\text{2}}}CO{\scriptstyle {\text{3}}}+CH{\scriptstyle {\text{4}}}}\)
- Гидрирование алкенов, алкинов, циклоалканов, алкадиенов, к примеру: \(\mathsf{C_nH_{2n} + H_2 \rightarrow C_nH_{2n+2}}\)
- \(\mathsf{C_nH_{2n-2} + 2H_2 \rightarrow C_nH_{2n+2}}\)
- Реакция Фишера-Тропша: \({\mathsf {nCO+(2n+1)H_{2}\rightarrow C_{n}H_{{2n+2}}+nH_{2}O}}\)
В сфере промышленности для получения алканов используют нефтепродукты, каменный уголь, природный и сопутствующий газ. В процессе переработки нефти реализуют такие химические реакции как ректификация, крекинг и прочие методики.
Применение
Алканы незаменимы в качестве сырья для производства химикатов, различных соединений и веществ, играют роль энергетического источника природного происхождения. С помощью алканов изготавливают разнообразную продукцию, к примеру:
- картриджи;
- резину;
- краску для типографских станков;
- растворители;
- хладагенты, то есть фреоны;
- метанол;
- ацетилен.
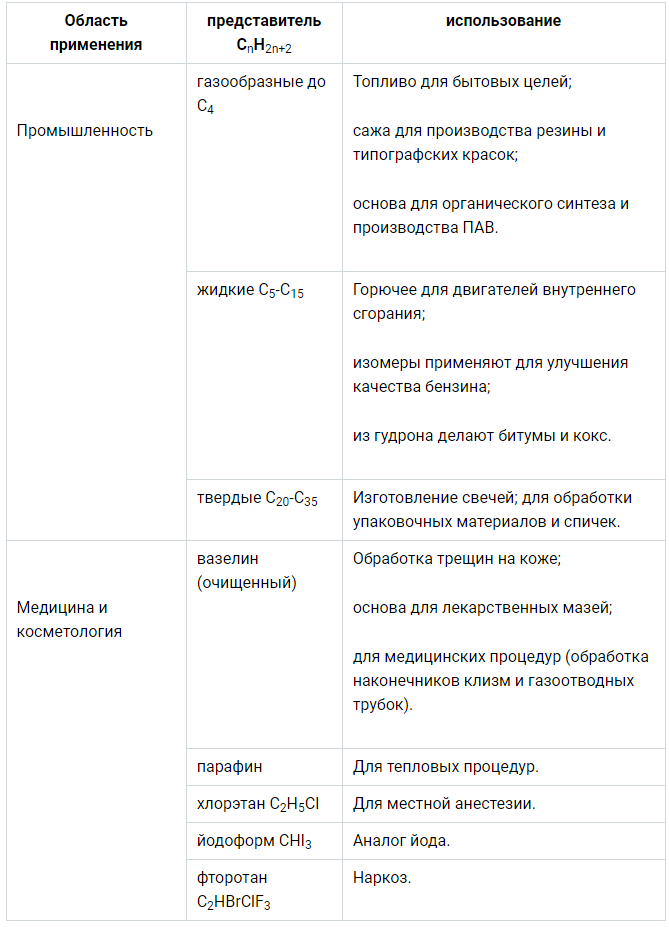
Области применения алканов можно рассмотреть с помощью табличной формы:
Источник: allinchemistry.ru
Сферы использования предельных углеводородов:
- производство пищевых продуктов;
- химическая промышленность;
- энергетический сектор;
- косметология;
- медицина.
Благодаря тому, что алканы обладают свойствами растворителей, вещества активно применяют в производстве лакокрасочной продукции и мазей. Материалы являются распространенными топливными ресурсами, а также незаменимы в изготовлении разных битумов. Сырье в виде алканов также используют в выпуске пластиков, ПАВов, синтетических полотен.
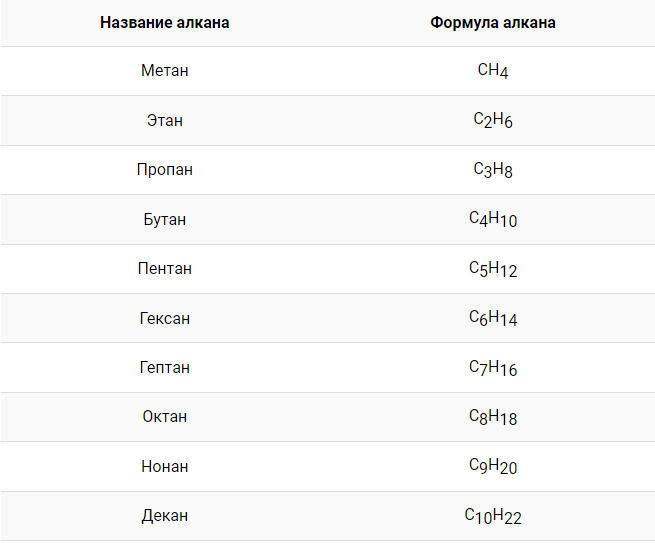
Гомологический ряд алканов
В процессе исследования алканов ученые пришли к выводу о том, что физико-химические свойства этих веществ схожи между собой и отличаются на единственную или несколько групп \(–СН_{2}–\) друг от друга. Описанные вещества принято считать гомологами. В последовательности гомологи образуют гомологический ряд.
На первом месте в гомологическом ряду расположен метан \(CH_{4} (Н–СH_{2}–H)\). С целью продления ряда гомологов следует добавлять группу \(–СН_{2}–\) в углеродную алкановую цепь, соблюдая последовательность.
Источник: chemege.ru
Единая формула, описывающая гомологический ряд алканов, имеет следующий вид:
\(C_{n}H_{2n+2}\)
С первого по четвертое вещество алканы представлены в газообразном состоянии. Начиная с \(C_{5} до C_{17}\) алканы находятся в жидком агрегатном состоянии, а \(с С_{18} —\) в твердом. Стоит отметить, что рассматриваемые материалы легче по сравнению с водой, а смешать алканы и водную среду не представляется возможным.
Номенклатура
При формулировке наименований алканов применяют суффикс –АН. В качестве типичного примера можно рассмотреть 2-метилпропан:
Источник: chemege.ru
В случае самых простых алканов, к примеру, метана, этана, пропана, бутана, изобутана, применимы тривиальные наименования. Следуя от углеводорода с пятью атомами, в названии нормальных, то есть без разветвления, алканов записывают корень, отображающий количество углеродных атомов в молекуле. Затем к полученной форме прибавляют соответствующий суффикс «ан».
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так