Определение и общая формула аминокислот, их классификация
Что такое аминокислоты
Где встречаются
Строительные блоки любой макромолекулы сходны по строению, т. е. имеют одинаковые химические группировки, своего рода скелет, характерный для каждого вида.
Он образуется при соединении строительных блоков химической связью и состоит из повторяющихся одинаковых групп. В основе белковой молекулы лежит пептидная связь, возникающая при реакции аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. От неизменного пептидного скелета ответвляются боковые группы аминокислот, строение которых зависит от вида аминокислоты. Каждый белок имеет свой неповторимый аминокислотный состав и уникальный порядок соединения аминокислот, называемый первичной структурой белка.
Для удобства двадцать главных аминокислот обозначают символами, используя одну или первые три буквы русского или английского наименования, например, аланин — Ала или А, глицин — Гли или G. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка — около 300 аминокислот. Одна часть молекул РНК, информационная, диктует последовательность аминокислот в белке, другая, рибосомная, способствует соединению аминокислот в белковую цепь. Хранится информация о составе белков в более прочных молекулах ДНК.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Основное значение
Для нормальной жизнедеятельности организм человека нуждается в полном наборе из двадцати основных аминокислот. Они участвуют в обмене веществ и используются в качестве сырья для получения многих биологически активных молекул: гормонов, алкалоидов, пигментов. В некоторых белках содержатся особые аминокислоты, не входящие в число двадцати стандартных. Они образуются модификацией нормальных аминокислот. Например, в белке соединительной ткани коллагене найдены 4-гидроксипролин и 5-гидроксилизин. От пролина и лизина они отличаются только гидроксильной группой. Эта группа необходима для образования прочных волокон коллагена.
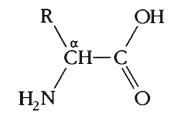
Общая формула аминокислот
Общим для всех аминокислот является наличие аминогруппы NH2.
Также в каждой их молекуле присутствует атом углерода, карбоксильная группа СООН, атом водорода и R-группа атомов, она же боковая цепь, различная для каждой аминокислоты. Благодаря наличию одновременно кислотной и аминной групп, всегда прикрепленных к одному и тому же атому углерода, аминокислоты способны проявлять как кислотные, так и щелочные свойства. Это позволяет их молекулам соединяться между собой.
Классификация
По радикалу
На основе химического строения радикала, R-группы, аминокислоты можно разделить на следующие группы:
- ароматические: триптофан, тирозин, фенилаланин;
- алифатические: глицин, аланин, валин, лейцин;
- серосодержащие: метионин, цистеин;
- гидроксилсодержащие: L-серин, L-трионин.
По функциональным группам
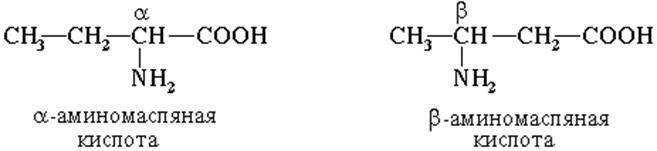
В этой классификации всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удаленности от карбоксильной группы в структурной формуле. Ближайший к ней атом называют \(\alpha\)-атомом, второй —\( \beta\)-атомом, следующий — \(\gamma\)-атомом и т. д. Атом углерода, который находится ближе всех к карбоксильной группе, \(\alpha\)-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют \(\alpha\)-аминокислотами. В природе встречаются аминокислоты, в которых аминная группа связана с более отдаленными от карбоксильной группы атомами углерода, но в построении белков участвуют именно\( \alpha\)-аминокислоты. Это обусловлено прежде всего тем, что только \(\alpha\)-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Также существует классификация по количеству функциональных групп:
- моноаминомонокарбоновые — одна карбоксильная и одна аминная группа;
- моноаминодикарбоновые — две карбоксильные и одна аминная группа;
- диаминомонокарбоновые — одна карбоксильная и две аминные группы.
По классам
Условно основные аминокислоты делят на четыре класса:
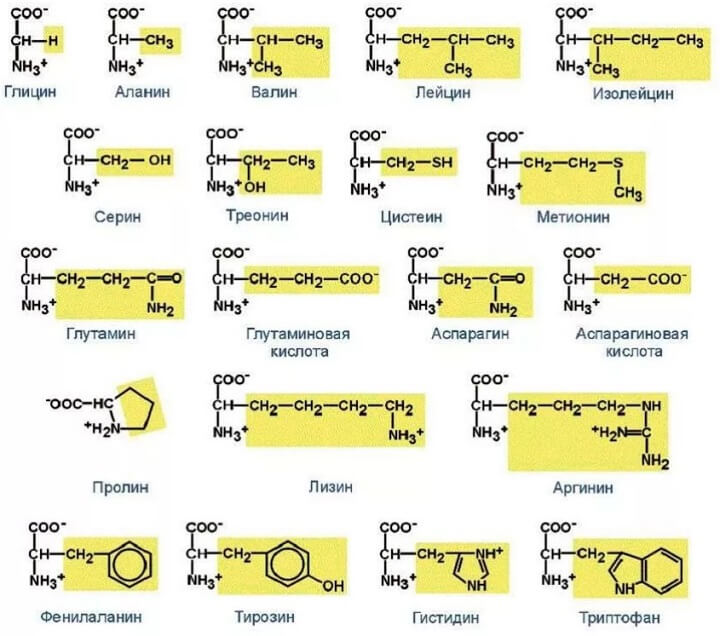
- С неполярными боковыми цепями: аланин, валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, пролин.
- Содержащие полярную группу: серин, треонин, тирозин, цистеин, аспарагин, глутамин, глицин.
- С боковыми цепями, которые могут заряжаться положительно при физиологических значениях рН: лизин, аргинин, гистидин.
- С боковыми цепями, которые могут заряжаться отрицательно при физиологических значениях рН: аспарагиновая кислота, глутаминовая кислота.
R-группа глицина представляет собой просто атом водорода, и эту аминокислоту трудно отнести к какому-нибудь из четырех классов. Такая боковая группа не может нести ни положительный, ни отрицательный заряд, не способна участвовать во взаимодействиях полярных R-групп или образовании водородных связей. Но у глицина, входящего в состав аминокислотной цепочки, есть две полярные группы — >С=О и >N-H. Поэтому глицин условно можно отнести к полярным аминокислотам.
По путям биосинтеза
Выделяют следующие биосинтетические семейства:
- аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин;
- глутамата: глутамат, глутамин, аргинин, пролин;
- пирувата: аланин, валин, лейцин;
- серина: серин, цистеин, глицин;
- пентоз: гистидин, фенилаланин, тирозин, триптофан.
По способности синтезировать из предшественников
Одни аминокислоты синтезируются в клетках самого организма, а другие должны поступать в готовом виде из пищевых продуктов. По биологической классификации аминокислоты делятся на три группы:
- заменимые, синтезирующиеся в организме человека: глицин, аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин;
- незаменимые: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан;
- условно незаменимые, синтезирующиеся в организме человека в недостаточном количестве: гистидин, аргинин.
По характеру катаболизма
По типу биодеградации аминокислоты делят на три группы:
- глюкогенные, метаболиты которых не повышают уровень кетоновых тел: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин;
- кетогенные, метаболиты которых повышают уровень кетоновых тел: лизин, лейцин;
- смешанные, образующие при распаде метаболиты обоих типов: триптофан, фенилаланин, изолейцин, тирозин.
Формулы важнейших аминокислот
Применение аминокислот
Аминокислоты используют для создания лекарственных препаратов и биологически активных протеиновых добавок, добавляют в корма для животных. Натриевая соль глутаминовой кислоты является усилителем мясного вкуса, поэтому ее можно встретить во многих пищевых продуктах, например, колбасах и консервах. Также аминокислоты используют в парфюмерной промышленности, в производстве красителей и моющих средств.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так