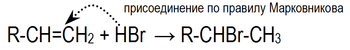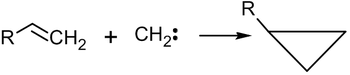Определение алкенов, химические свойства, способы получения
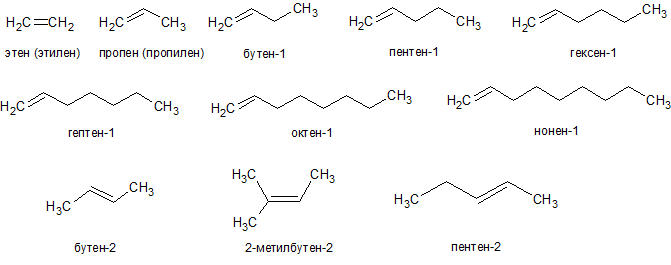
Что такое алкены
Алкены представляют собой непредельные, или ненасыщенные, нециклические углеводороды с молекулами, имеющими единственную двойную связь между углеродными атомами С=С.
Благодаря такому строению, вещества приобретают уникальные свойства. Их почти невозможно найти в природном мире. Наиболее простым представителем алкенов является этилен (С2Н4). Данное органическое соединение играет роль гормона для растительных организмов и формируется в них в малых количествах.
В природе встречается мускалур, который также является алкеном. Другое название цис-трикозен-9. Это половой аттрактант самки домашней мухи под названием Musca domestica.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Если низшие алкены представлены в достаточно большом содержании, то они могут оказывать наркотическое действие. Высшие алкены способны приводить к таким неприятным последствиям, как судороги, оказывают раздражающий эффект на оболочки слизистых, которыми покрыты дыхательные пути.
Наибольшее распространение получили такие алкены, как:
- Этилен. Способен вызывать наркоз. Вещество характеризуется раздражающим и мутагенным эффектом.
- Пропилен. Также обладает свойством вызывать наркоз, по эффективности является более сильным по сравнению с этиленом. Соединение обладает общетоксическим и мутагенным действием.
- Бутен-2. Имеет способность вызывать наркоз и раздражение.
Алкены высоко ценятся в промышленности в качестве сырья для производства химикатов и продукции разного целевого назначения. Например, из этилена изготавливают химические соединения:
- винилхлорид;
- стирол;
- этиленгликоль;
- этиленоксид;
- этаноламины;
- этанол;
- диоксан;
- дихлорэтан;
- уксусный альдегид;
- уксусная кислота.
Путем полимеризации этилена, а также его прямых производных, синтезируют следующие виды химической продукции:
- полиэтилен;
- поливинилацетат;
- поливинилхлорид;
- каучуки;
- смазочные масла.
В современной промышленности применяют попилен. Из данного соединения производят в большей степени полипропилен. Другими продуктами производства являются:
- кумол;
- окись пропилена;
- акрилонитрил;
- изопропанол;
- глицерин;
- масляный альдегид.
Другие алкены также обладают большой ценностью для промышленного сектора. К примеру, из бутиленов производят:
- бутадиен;
- изопрен;
- полиизобутилен;
- бутилкаучук;
- метилэтилкетон.
Изобутилен используют в качестве сырья в синтезе бутилкаучука, изопрена, трет-бутанола. Соединение необходимо для алкилирования фенолов, что является неотъемлемым этапом синтеза ПАВ. Сополимеры данного вещества с бутенами играют роль модификаторов в процессе изготовления масел и герметизирующих составов. С помощью высших алкенов С10−С18 синтезируют ПАВ и получают высшие спирты.
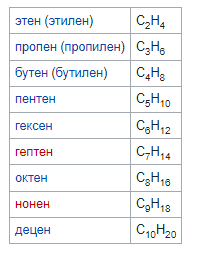
Гомологический ряд алкенов
Алкены с количеством атомов, превышающим 2 единицы, то есть все, за исключение этилена, обладают изомерами. Изомерия алкенов:
- изомерия углеродного скелета;
- изомерия расположения двойной связи;
- межклассовая изомерия;
- геометрическая изомерия.
Пропилен обладает лишь одним изомером под названием циклопропан (C3H6), согласно межклассовой изомерии. Если начинать отсчет с бутилена, то можно заметить существование изомеров, исходя из положения двойной связи, (бутен-1 и бутен-2). Также в этом случае наблюдается изомерия по углеродному скелету (изобутилен или метилпропилен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). По мере возрастания количества углеродных атомов стремительно увеличивается число изомеров в цепочке.
Строение алкенов
Алкены обладают единственной двойной связью между углеродными атомами. Вещества формируют гомологический ряд и имеют общую формулу.
Формула алкенов:
CnH2n
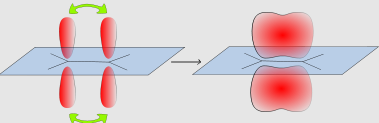
Углеродные атомы, участвующие в двойной связи, пребывают в состоянии \(sp^{2} \) гибридизации. Они обладают валентным углом, который равен 120°. Самым простым среди алкенов является этилен (C2H4).
Исходя из номенклатуры IUPAC, наименования соединений данного вида формируются на основании соответствующих алканов. При этом меняется суффикс «-ан» на «-ен». Для того чтобы указать расположение двойной связи, принято использовать арабские цифры. В названии углеводородных радикалов, образованных от алкенов, присутствует суффикс «-енил». Тривиальными наименованиями являются: CH2=CH— «винил», CH2=CH—CH2— «аллил».
Этил обладает следующей пространственной структурой:
Исходя из теории гибридизации, образование двойной связи объясняется перекрыванием по линии связи \(С-С sp^{2}\) -гибридных орбиталей углеродных атомов (\(\sigma\)-связь) и перекрыванием сбоку углеродных p-орбиталей (\(\pi-\)связь).
На рисунке изображена схема, согласно которой формируются связи в молекуле этилена:
Запишем электронное строение углеродного атома, который пребывает в состоянии \(sp^{2}\) –гибридизации:
\(C^{{*}}\quad {\frac {\uparrow \downarrow }{1s}}\;{\frac {\uparrow \,}{sp^{2}}}\;{\frac {\uparrow \,}{sp^{2}}}{\frac {\uparrow \,}{sp^{2}}}{\frac {\uparrow \,}{p}}\)
Заметим, что в данном случае каждый из атомов этилена расположен в одной плоскости. Валентный угол, характерный для связи C-H, почти равен 120°. В этом случае центры атомов углерода в молекуле этилена удалены на 0,134 нм. В результате двойная связь имеет меньшую длину по сравнению с С-С.
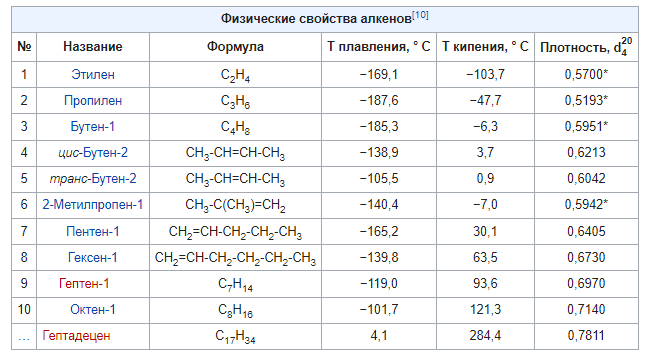
Физические и химические свойства алкенов
Алкены характеризуются такими температурами плавления и кипения, которые повышаются по мере увеличения молекулярной массы и длины основной углеродной цепи веществ. Если условия соответствуют нормальным, соединения принимают следующие агрегатные состояния:
- от C2H4 до C4H8 являются газами;
- от пентена C5H10 до гептадецена C17H34 включительно имеют жидкое состояние;
- от октадецена C18H36 представляют собой твердые материалы.
Алкены нерастворимы в водной среде. Соединения достаточно просто можно растворить в растворителях органического происхождения. Некоторые физические свойства представлены в таблице:
Алкены характеризуются химической активностью. Благодаря имеющейся двойной связи у веществ формируются определенные химические свойства. Наиболее распространенными с участием алкенов являются такие реакции, как электрофильное присоединение и радикальное присоединение.
Процесс нуклеофильного присоединения алкенов можно наблюдать лишь при условии, что в реакции участвует сильный нуклеофил. Подобное химическое взаимодействие не является типичным для данного вида органических соединений. Особенность алкенов заключается в том, что они участвуют в реакциях циклоприсоединения и метатезиса.
Алкены достаточно просто окисляются, гидрируются при наличии сильных восстановителей или водорода. При этом во взаимодействии участвуют катализаторы. Алкены обладают способностью к радикальному замещению.
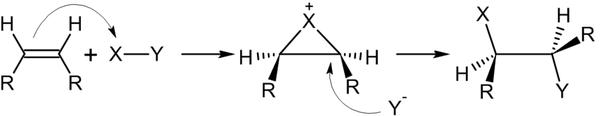
В реакциях электрофильного присоединения роль атакующей частицы играет электрофил. Алкены вступают в реакции галогенирования. Процесс протекает без инициаторов радикальных реакций. Это характерная реакция электрофильного присоединения, которая осуществляется в среде, состоящей из неполярных инертных растворителей (к примеру,CCl4):
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+Br_{2}}}\rightarrow {\mathsf {R\!\!-\!\!CHBr\!\!-\!\!CH_{2}Br}}\)
Общий вид реакций галогенирования представлен на схеме:
Галогеноводороды присоединяются к алкенам в процессе реакции электрофильного присоединения, которая реализуется согласно правилу Марковникова:
В качестве примера можно привести присоединение HBr:
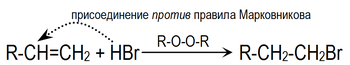
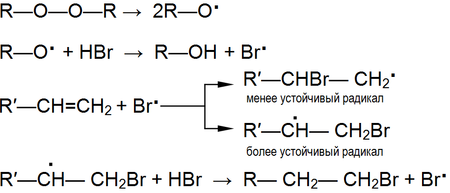
Если имеются перекиси, то реакция присоединения в большей степени протекает против правила Марковникова, то есть наблюдается эффект Хараша:
Гидроборирование является химической реакцией присоединения гидридов бора к алкенам, которая протекает по многоступенчатому механизму. Результат химического взаимодействия представляет собой расщепление гидридов бора в щелочной среде и образование промежуточного циклического активированного комплекса. Реакция протекает против правила Марковникова:
Гидратация представляет собой реакцию, в процессе которой вода присоединяется к алкенам при наличии серной кислоты:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+H_{2}O}}\rightarrow {\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}}}\)
Алканы присоединяются к алкенам, если в среде имеется кислотный катализатор в виде HF или H2SO4. Температура должна быть низкой, тогда происходит синтез углеводорода, обладающего большей молекулярной массой, востребованный в современной промышленности. Уравнение реакции:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+R'\!\!-\!\!H}}\rightarrow {\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}R'}}\)
Когда катализатор отсутствует, реакция реализуется согласно свободнорадикальному механизму при нагреве до 500 °C и давлении от 15 до 30 Мпа.
Перечислим другие реакции электрофильного присоединения.
Спирт присоединяется к алкенам, что приводит к образованию простого эфира:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+R'\!\!-\!\!OH}}\rightarrow {\mathsf {R\!\!-\!\!CH(OR')\!\!-\!\!CH_{3}}}\)
Реакция оксимеркурирования-демеркурирования, в результате которой образуются спирты:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+(CH_{3}COO)_{2}Hg+H_{2}O}}\rightarrow {\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{2}\!\!-\!\!Hg\!\!-\!\!O\!\!-\!\!C(O)CH_{3}+CH_{3}COOH}}\)
\({\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{2}\!\!-\!\!Hg\!\!-\!\!O\!\!-\!\!C(O)CH_{3}+H_{2}}}{\stackrel {NaBH_{4}}{\longrightarrow }}{\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}+Hg+CH_{3}COOH}}\)
К алкенам присоединяется хлорноватистая кислота, что приводит к образованию хлоргидринов:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+Cl_{2}+H_{2}O}}\rightarrow {\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{2}Cl+HCl}}\)
Присоединение хлорангидридов к алкенам сопровождается дальнейшим образованием ненасыщенных кетонов по реакции Кондакова в присутствии катализатора ZnCl2:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+R'\!\!-\!\!COCl}}\rightarrow {\mathsf {R\!\!-\!\!CHCl\!\!-\!\!CH_{2}COR'}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!COR'+HCl}}\)
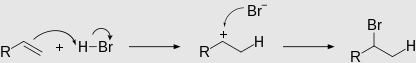
Существуют условия, при которых происходит гомолитический разрыв связи, например:
- нагрев;
- облучение;
- присутствие свободных радикалов.
В таком случае присоединение к алкенам можно описать радикальным механизмом:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+HCl}}\rightarrow {\mathsf {R\!\!-\!\!CH_{2}Cl\!\!-\!\!CH_{3}}}\)
Здесь выполняется правило Марковникова.
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+COCl_{2}}}\rightarrow {\mathsf {R\!\!-\!\!CHCl\!\!-\!\!CH_{2}COCl}}\)
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+CCl_{4}}}\rightarrow {\mathsf {R\!\!-\!\!CHCl\!\!-\!\!CH_{2}CCl_{3}}}\)
Изобразим механизм, согласно которому протекает реакция:
Карбены CR2 являются частицами с коротким жизненным циклом и повышенной способностью к реакциям. Данные частицы достаточно просто присоединяются к двойной связи алкенов. Итогом химического взаимодействия является образование производных циклопропана:
Данные реакции характерны не только в случае карбена, но и протекают с его производными:
\({\mathsf {CCl_{2},CBr_{2},C(CN)_{2},C}}\!\!=\!\!{\mathsf {C(CH_{3}),RCOCH}}\)
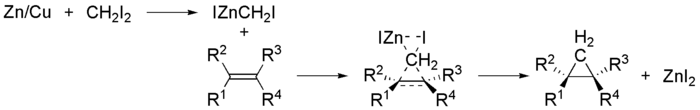
Реакция Симмонса-Смита реализуется в лабораторных условиях по схеме:
Механизм гидрирования алкенов по реакции Сабатье-Сандеран:
\(\mathsf{R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R'+H_2}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\!CH_2\!\!-\!\!R'}\)
Гидрирование алкенов с помощью водорода протекает при наличии катализаторов. Роль гетерогенных катализаторов в процессе гидрирования играют:
- платина;
- палладий;
- никель.
Если температура среды достаточно высока и составляет выше 400 °C, то можно наблюдать подавление обратимых реакций радикального присоединения. Тогда появляется возможность заместить водородный атом, который пребывает в аллильном положении, не меняя двойную связь:
\({\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH_{2}+Cl_{2}}}\rightarrow {\mathsf {ClCH_{2}\!\!-\!\!CH\!\!=\!\!CH_{2}+HCl}}\)
Данное химическое взаимодействие обладает радикальным характером и реализуется так же, как хлорирование алканов.
Возможно два варианта окисления алканов:
- разрыв двойной связи;
- сохранение углеродного скелета.
Данные результаты определяются условиями течения реакции и тем, какой тип реагентов выбран для окисления.
Рассмотрим случай, когда алкены окисляют неорганическими окислителями. Если условия мягкие, то реакция осуществляется с помощью присоединения по двойной связи пары гидроксильных групп:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R+OsO_{4}+2H_{2}O}}\rightarrow {\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH(OH)\!\!-\!\!R+OsO_{2}(OH)_{2}}}\)
Сначала оксид осмия присоединяется к алкену. Далее полученный комплекс испытывает на себе действие восстановителя в виде Zn или NaHSO3, что является причиной его перехода к диолу по Реакции Криге.
Похожий сценарий характерен для реакции в условиях нейтральной или слабощелочной среды. Здесь действие оказывает KMnO4 по реакции Вагнера:
\({\mathsf {3CH_{2}\!\!=\!\!CH_{2}+2KMnO_{4}+4H_{2}O}}\rightarrow {\mathsf {3CH_{2}OH\!\!-\!\!CH_{2}OH+2KOH+2MnO_{2}}}\)
Двойная связь разрывается, если на алкены оказывают воздействие сильные окислители в виде KMnO4 или K2Cr2O7 в среде Н2SO4:
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R+[O]}}\rightarrow {\mathsf {2R\!\!-\!\!COOH}}\)
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!C(R)(R')+[O]}}\rightarrow {\mathsf {R\!\!-\!\!COOH+R\!\!-\!\!C(O)\!\!-\!\!R'}}\) (кетон)
В некоторых случаях, например, при окислении алкенов с помощью нитрата (III) таллия, можно наблюдать перегруппировку, согласно такой схеме:
\({\mathsf {R\!\!-\!\!C(R)\!\!=\!\!CH\!\!-\!\!R+[O]}}\rightarrow {\mathsf {R\!\!-\!\!C(O)\!\!-\!\!CH(R)R}}\)
Реакция окисления алкенов протекает при наличии солей палладия. Для примера запишем уравнение реакции окисления этилена с помощью солей палладия, что приводит к образованию ацетальдегида:
\({\mathsf {2CH_{2}\!\!=\!\!CH_{2}+O_{2}}}\rightarrow {\mathsf {2CH_{3}CHO}}\)
Данное химическое взаимодействие реализуется в условиях кислой среды. Это промышленный метод синтеза ацетальдегида. Таким же способом получают ацетон из пропена.
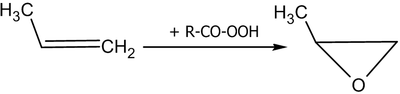
Эпоксидирование представляет собой процесс химического воздействия пероксикарбоновых кислот на алкены, что приводит к образованию эпоксидов, называется реакцией Прилежаева:
С помощью реакции эпоксидирования получают в промышленных масштабах этиленоксид. В качестве окислителя используют воздушный кислород. Реакция осуществляется под давлением при наличии серебряного катализатора. Температурный режим соответствует интервалу от 200 °C до 250 °C.
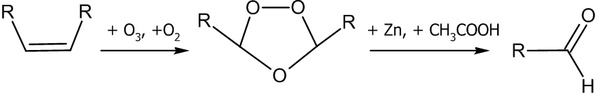
Озонолиз алкенов чаще всего реализуют в условиях низких температур от −80 °C до −30 °C. При этом используют инертный растворитель, например:
- гексан;
- тетрахлорметан;
- хлороформ;
- этилацетат.
Не предусмотрено выделение продуктов реакции озонолиза. Полученные соединения участвуют в других реакциях — таких, как:
- гидролиз;
- окисление;
- восстановление.
Схема реакции озонолиза в мягких условиях:
Озонолиз при жестких условиях протекает следующим образом:
\({\mathsf {R'\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R''+O_{3}}}\rightarrow {\mathsf {R'\!\!-\!\!COOH+R''\!\!-\!\!COOH+H_{2}O}}\)
Алкены вступают в реакции карбонилирования. Если предусмотрено применение катализатора, температура и давление достаточно высоки, то алкены способны присоединять CO и H2. В результате синтезируются альдегиды:
\({\mathsf {CH_{2}\!\!=\!\!CH_{2}+CO+H_{2}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH_{2}\!\!-\!\!CHO}}\)
Таким же образом реализована реакция CO и H2O, которая сопровождается образованием карбоновых кислот:
\({\mathsf {CH_{2}\!\!=\!\!CH_{2}+CO+H_{2}O}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH_{2}\!\!-\!\!COOH}}\)
При замене воды спиртом итогом реакции станет сложный эфир:
\({\mathsf {CH_{2}\!\!=\!\!CH_{2}+CO+C_{2}H_{5}OH}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH_{2}\!\!-\!\!COOC_{2}H_{5}}}\)
Возможно несколько механизмов течения реакции полимеризации алкенов:
- свободнорадикальный;
- катионно-анионный.
В первом случае побочным продуктом реакции является полиэтилен высокого давления:
\({\mathsf {n\ CH_{2}\!\!=\!\!CH_{2}}}\rightarrow {\mathsf {-[-\!CH_{2}\!\!-\!\!CH_{2}\!-]_{n}-}}\)
Роль катализатора при этом играют пероксиды.
Катионно-анионный механизм предусматривает наличие катализаторов кислот и металлорганических соединений. Достоинства данного способа полимеризации заключаются в синтезе стереоселективных полимеров.
Метатезис алкенов является реакцией, при которой происходит обмен атомами при неизменной общей структуре алкена и его двойной связи. Реакция протекает при катализе хлоридом вольфрама \((VI)\):
\({\mathsf {R\!\!-\!\!C\!\!=\!\!C\!\!-\!\!R'+R''\!\!-\!\!C\!=\!\!C\!\!-\!\!R'''}}\rightarrow {\mathsf {R\!\!-\!\!C\!\!=\!\!C\!\!-\!\!R''+R'\!\!-\!\!C\!\!=\!\!C\!\!-\!\!R'''}}\)
Идентифицировать алкены можно определенными химическими способами. Наиболее распространенным методом является реакция Вагнера. В процессе можно наблюдать, как раствор перманганата калия в условиях слабощелочной среды теряет свою окраску. Таким образом, алкены окисляются до гликолей.
Вторым известным способом обнаружения алкенов является реакция присоединения. Бромный раствор теряет свою окраску при контакте с четыреххлористым углеродом. При этом не выделяется бромоводород.
Способы получения алкенов
Главным способом синтеза алкенов в промышленности является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. С целью получения низших алкенов применяют реакцию дегидратации соответствующих спиртов.
В условиях лаборатории используют следующие методики синтеза алкенов:
- дегидратация спиртов при наличии сильных минеральных кислот;
- дегидрогалогенирование;
- дегалогенирование соответствующих галогенпроизводных;
- синтез Гофмана;
- синтез Чугаева;
- синтез Виттига;
- синтез Коупа.
Рассмотрим промышленный способ синтеза алкенов под названием дегидрирование. Температурный режим при этом должен соответствовать от 350 °C до 450 °C. Роль катализатора играет Cr2O3, либо алюмомолибденовые и алюмоплатиновые катализаторы. С целью получения транс-алкенов применяют \(MOH/EtOH,\) для цис-производных \(NaNH2/NH3.\)
\({\mathsf {CH_{3}\!\!-\!\!CH_{3}}}\rightarrow {\mathsf {CH_{2}\!\!=\!\!CH_{2}+H_{2}}}\)
\({\mathsf {(CH_{3})_{2}CH\!\!-\!CH_{3}}}\rightarrow {\mathsf {(CH_{3})_{2}C\!\!=\!\!CH_{2}+H_{2}}}\)
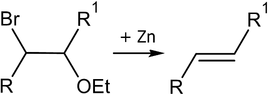
Другими способами получения алкенов являются дегидрогалогенирование и дегалогенирование алканов. Например, от дигалогеналканов отщепляют галогены при наличии цинка:
\({\mathsf {R\!\!-\!\!CHCl\!\!-\!\!CH_{2}Cl+Zn}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+ZnCl_{2}}}\)
Процесс дегидрогалогенирования протекает в условиях повышенной температуры при воздействии спиртовыми растворами щелочей:
\({\mathsf {R\!\!-\!\!CHBr\!\!-\!\!CH_{3}+C_{2}H_{5}ONa}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+NaBr+C_{2}H_{5}OH}}\)
Когда отщепляется галогенводород, получается смесь изомеров. В образованном комплексе преобладает изомер, определенный по правилу Зайцева, то есть протон отщепляется от минимально гидрогенизированного углеродного атома.
Алкены синтезируют путем дегидратации спиртов. При этом соблюдается повышенная температура бани, в реакции присутствуют сильные минеральные кислоты:
\({\mathsf {CH_{3}\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}+H_{2}SO_{4}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH(OSO_{3}H)\!\!-\!\!CH_{3}+H_{2}O}}\)
\({\mathsf {CH_{3}\!\!-\!\!CH(OSO_{3}H)\!\!-\!\!CH_{3}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH_{2}+H_{2}SO_{4}}}\)
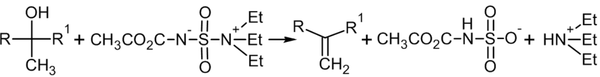
С помощью дегидратирующего реагента под названием реагент Берджесса в практических условиях получают алкены из вторичных и третичных спиртов:
Реализация процесса частичного гидрирования алкинов предусматривает создание особых условий и присутствие катализатора, например, в виде дезактивированного палладия под названием катализатор Линдлара:
\({\mathsf {CH_{3}\!\!-\!\!C}}\!\!\equiv \!\!{\mathsf {C\!\!-\!\!CH_{3}+H_{2}}}\ {\xrightarrow {Pd/Pb(CH_{3}COO)_{2}}}\ {\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_{3}}} (цис-изомер)\)
\({\mathsf {CH_{3}\!\!-\!\!C}}\!\!\equiv \!\!{\mathsf {C\!\!-\!\!CH_{3}+2Na+2NH_{3}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_{3}}} (транс-изомер) {\mathsf {+2NaNH_{2}}}\)
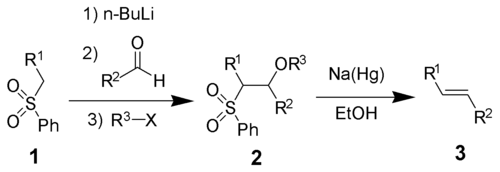
Алкены можно получать с помощью стереоселективного синтеза, который называют реакцией Виттига. При этом в реакцию вступают карбонильные соединения и алкилиденфосфораны (илиды фосфониевых солей):
\({\mathsf {(C_{6}H_{5})_{3}P+CH_{3}Br}}\rightarrow {\mathsf {[(C_{6}H_{5})_{3}P\!\!-\!\!CH_{3}]Br}}\)
\({\mathsf {[(C_{6}H_{5})_{3}P\!\!-\!\!CH_{3}]Br+C_{6}H_{5}Li}}\rightarrow {\mathsf {(C_{6}H_{5})_{3}P\!\!-\!\!CH_{2}\!\!:+}}{\mathsf {C_{6}H_{6}+LiBr}}\)
\({\mathsf {CH_{3}\!\!-\!\!CO\!\!-\!\!CH_{3}+(C_{6}H_{5})_{3}P\!\!-\!\!CH_{2}\!\!:}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!C(CH_{3})\!\!=\!\!CH_{2}+(C_{6}H_{5})_{3}P\!\!=\!\!O}}\)
Превратить соли фосфония в илиды можно с помощью следующих веществ:
- бутиллитий;
- гидрид, амид или алкоголят натрия;
- определенные сильные основания.
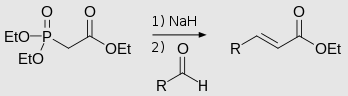
Если рассматривать лабораторные условия, то более современной альтернативой реакции Виттига является реакция Хорнера-Уодсворта-Эммонса:
Перечислим другие реакции, позволяющие синтезировать алкены:
- Реакция Кневенагеля:
- Реакция Чугаева:
\({\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}OH+CS_{2}+NaOH}}\rightarrow {\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}OC(S)\!\!-\!\!SNa+H_{2}O}}\)
\({\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}OC(S)\!\!-\!\!SNa}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+COS+NaHS}}\)
- Реакция Гофмана:
\({\mathsf {(C_{2}H_{5})_{4}N^{+}OH^{-}}}\rightarrow {\mathsf {CH_{2}\!\!=\!\!CH_{2}+(C_{2}H_{5})_{3}N+H_{2}O}}\)
- Реакция Коупа:
- Реакция Бурда:
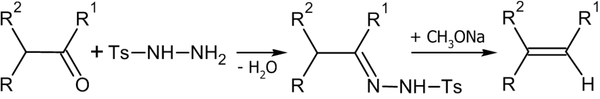
- Синтез из тозилгидразонов:
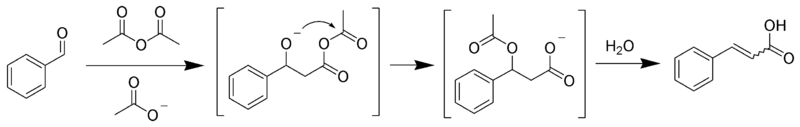
- Реакция Перкина:
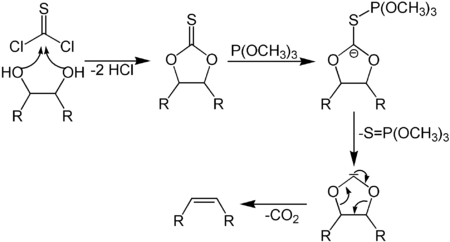
- Синтез Кори — Винтера:
- Олефинирование Жюлиа — Лижо:
Источник: ru.wikipedia.org.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так