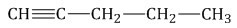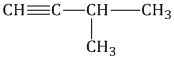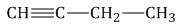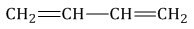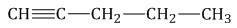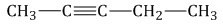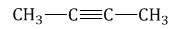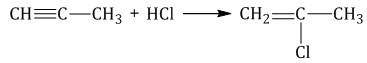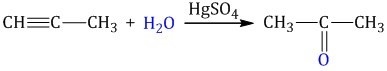Способы получения алкинов
Что такое алкины
Алкины — углеводороды, которые не обладают насыщенностью и цикличностью. В молекулах данных соединений можно обнаружить тройную связь между углеродными атомами \(C\equiv{C}\).
Гомологический ряд данных веществ
Практически у всех алкинов сходные характерные черты как со стороны химии, так и со стороны физики. Те алкины, которые похожи по строению, но имеют небольшие отличия на одну или некоторое количество групп \(-CH_{2}-\), именуются гомологами. Именно они способны создавать гомологические ряды. Этин является первым веществом из гомологической цепочки алкинов. Он имеет такое обозначение: \(C_{2}H_{2}\) или же \(CH\equiv{CH}\). Продолжение данного ряда создается посредством добавления \(-CH_{2}-\) в цепочку углеводорода.
Для всей гомологической последовательности формула будет выглядеть так: \(C_{n}H_{2n-2}\).
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Газами являются три первых элемента углеводородного ряда, жидкостями же являются все элементы с \(C_{5}H_{8} до C_{16}H_{30}\), а все что с \(C_{17}H_{32}\) находится в твердом состоянии. Алкины являются гидрофобными, но при этом хорошо растворяются в растворителях органического происхождения.
Структура алкина
Прекрасным примером характерных черт строения алкина является ацетилен. Посмотрите: в ацетиленовой молекуле есть разные химические соединения, например, \(C-H\), а также \(C\equiv{C}\) .
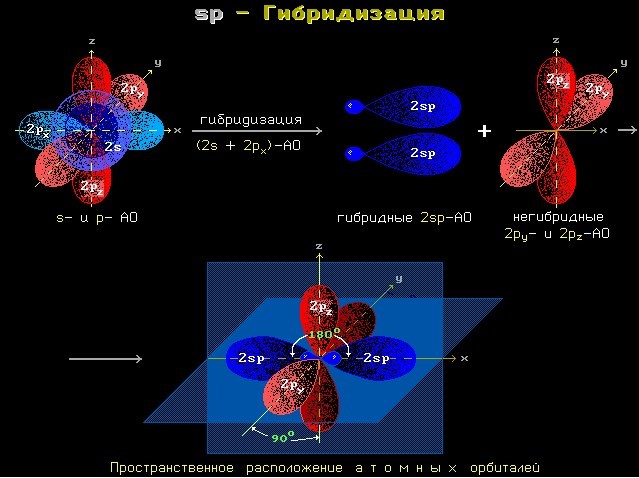
Соединение \(C-H\) обладает ковалентностью и слабой полярностью, также она характеризуется одинарными \(\sigma-связями\). В это же время соединение \(C\equiv{C}\) является тройным, проявляется ковалентность, не обладает полярностью, есть лишь одна \(\sigma-связь\), другие связи — \(\pi\) . Углеродные атомы в случае тройной связи формируют две пары \(\sigma-связи\), а также две пары \(\pi-связи\). Получается, что процесс углеродной гибридизации в случае тройной связи в молекулах алкинов будет sp:
Источник: chemege.ru
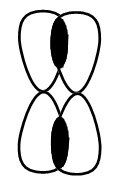
Когда создается \(\sigma-связь\) между углеродными атомами, наблюдается перекрывание sp-гибридных орбиталей углеродных атомов:
Источник: chemege.ru
В процессе создания \(\pi-связей\) между углеродными атомами наблюдается перекрывание негибридных орбиталей углеродных атомов:
Источник: chemege.ru
Происходит обоюдное отталкивание двух sp-гибридных орбиталей углеродного атома. Они помещаются внутри вещества таким образом, чтобы угол создавался очень большой угол между орбиталями. Из-за этого две гибридные атомные орбитали углерода в случае формирования тройной связи в алкиных соединениях направляются внутрь при угле в 180 градусов.
Источник: chemege.ru
Все вышесказанное имеет соответствие с линейной молекулярной структурой. К примеру, у ацетиленовой молекулы \(C_{2}H_{2}\) наблюдается линейная структура.
Источник: chemege.ru
Если у алкинов наблюдается много углеродных атомов, то о таких алкинах говорят, что их структура пространствена. К примеру, в пропиновой молекуле наблюдается углеродный атом в \(sp^{3}-гибридной\) позиции, при этом данная молекула является лишь фрагментом метила \(CH_{3}\). У данного фрагмента будет наблюдаться структура тетраэдра.
Изомерия у алкинов
Данным веществам свойственны следующие типы изомерии:
- структурная;
- пространственная.
Структурная изомерия
Алкины отличаются тем, что у них происходит изомерия из углеродной основы, состояния кратной связи, а также изомерия между классами.
Структурные изомеры — связи с похожей структурой, что разнятся только посредством последовательности атомного связывания в рамках молекулы, то есть различаются по молекулярной структуре.
Изомеры скелета углерода имеют иную структуру скелета углерода. К примеру, различными по структуре являются изомеры с разными углеродными основами и одной формулой \(C_{5}H_{8}\) : пентин-1 и 3-метилбутин-1.
У пентина-1 такой вид:
Источник: chemege.ru
У 3-метилбутина-1 такой вид:
Источник: chemege.ru
Изомеры межклассового типа — элементы различных классов, которые имеют разную структуру, однако один состав. Можно считать, что изомерия такого типа у алкинов проявляется с алкадиенами.
У них даже одна формула: \(C_{n}H_{2n-2}\). Посмотрите на простой пример: бутин-1 и бутадиен с одной формулой \(C_{4}H_{6}\).
Так выглядит по структуре Бутин-1:
Источник: chemege.ru
Так выглядит по структуре бутадиен:
Источник: chemege.ru
Изомеры, у которых различается позиция тройной связи, разнятся по тому, где располагается тройная связь в рамках скелета углерода. К примеру, такими являются изомеры с формулой \(C_{5}H_{8}\): пентин-1 и 2.
Так выглядит по структуре пентин-1:
Источник: chemege.ru
Так выглядит по структуре пентин-2:
Источник: chemege.ru
Пространственная изомерия
Части алкинов присуща оптическая изомерия. Но подобный вид изомерии наблюдается только в случае, когда у алкина очень большой скелет углерода. В рамках алкиной молекулы в таком случае обязан быть асимметрический углеродный атом (то есть тот, у которого есть четыре разных заместителя). При этом не наблюдается у алкинов цис-транс-изомерии, потому что нельзя совершить вращение по тройной связи.
Терминология алкинов
В огромном количестве алкинов для того, чтобы показать, что присутствует тройная связь, присоединяют -ин- в качестве суффикса. К примеру, данный алкин, изображенный ниже, носит название бутин-2.
Источник: chemege.ru
В случае самых простых алкинов используют названия, которые уже давно используются по мере исторического развития. Так, например, ацетиленом зовут алкин с формулой \(CH\equiv{CH}\), пропином — \(CH\equiv{C-CH_{3}}\), бутином-1 — \(CH\equiv{C-CH_{2}-CH_{3}}\).
У радикалов, которые обладают тройной связью, тоже есть обычные (исторические) имена: этинилом называют \(CH\equiv{C-}\), а пропаргилом называют \(CH\equiv{C-CH_{2}-}. \)
Химические характеристики алкинов
Как уже говорилось выше, алкины являются углеводородами без предела. Внутри алкинов — в их молекулах — содержится тройная связь. Структуру и характерные черты тройной связи обуславливают различные свойства алкинов со стороны химии. Во многом химические характеристики у алкинов похожи на то, что имеют алкены, потому что и у тех, и других есть кратная молекулярная связь.
Характерными для алкинов являются окислительные реакции. Обычно окисление происходит посредством тройной связи, но бывает и очень жесткое окисление (вещество горит).
Реакции объединения
Как известно, тройная связь формируется из одной \(\sigma-связи\) и пары \(\pi-связей\). Сопоставим свойства связи одинарного типа С-С, \(C\equiv{C}\) — тройной связи, а также C-H связи.
| Энергия связи, кДж\моль | Длина связи, нм |
| С-С, 348 | 0,154 |
| \(C\equiv{C}, 814\) | 0,120 |
| C-H, 435 | 0, 107 |
Получается, что связь \(C\equiv{C}\) намного короче связи С-С, из-за этого \(\pi-электроны\) у тройных связей намного прочнее закрепляются углеродными атомами, при этом у них меньше колебания и уровень поляризации. Все реакции соединения в рамках тройной связи очень трудны по своей сути. Намного сложнее таких же реакции, но в рамках двойной связи и с алкенами. Алкинам присущи объединительные реакции в рамках тройной связи \(C\equiv{C}\), но при этом будут разрываться \( \pi-связи\).
Гидрирование
Данная реакция может быть проведена только в случае, если есть какой-нибудь катализатор. Обычно ими являются Ni, Pt. В итоге данной реакции образуются алкены, а после уже — алканы. К примеру, в процессе гидрирования бутин-2, если в реакцию вступает еще и никель, то формируется в первую очередь бутен-2, а после уже бутан.
\(CH_{3}-C\equiv{C}-CH_{3}+H_{2}\rightarrow^{Ni, t, p}CH_{3}-CH=CH-CH_{3}\)
\(CH_{3}-C\equiv{C}-CH_{3}+H_{2}\rightarrow^{Ni, t, p}CH_{3}-CH_{2}-CH_{2}-CH_{3}\)
Если применять какой-нибудь катализатор, который является менее активным (например, Pd), то гидрирование не будет совершаться на моменте создания алкенов.
К примеру, в процессе гидрирования бутин-1, если в реакцию также вступает палладий, то формируется больше бутен-1: \(CH\equiv{C}-CH_{2}-CH_{3}+H_{2}\rightarrow^{Pd, t, p}CH_{2}=CH-CH_{2}-CH_{3} \)
Галогенирование алкинов
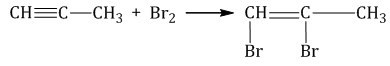
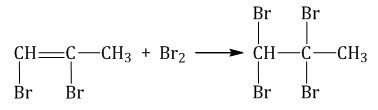
Соединить галоген и алкин возможно даже в условиях температуры, которая наблюдается в комнате. Единственное — эксперимент надо проводить в растворе. Для данного опыта нужны растворители вроде воды или же \(CCl_{4}\) . В процессе взаимного влияния алкинов друг на друга будет происходить обесцвечивание бромового раствора в воде, то есть раствор потеряет свой красный цвет. Можно говорить о том, что данная реакция является показательной на тройную связь.
К примеру, при реакции брома и пропина, изначально будут формироваться 1,2-дибромпропен, а потом уже 1,1,2,2-тетрабромпропан.
Вот так выглядит реакция:
Источник: chemege.ru
Примерно таким же образом происходит реакция алкинов и хлора, однако не случается обесцвечивание хлорной воды. Все из-за того, что хлорная вода не имеет цвета. Все реакции способны происходить только тогда, когда есть полярные растворители по электрофильной схеме.
Гидрогалогенирование алкинов
В рамках данной реакции к алкинам должны добавиться галогеноводороды. Обычно все происходит по схеме электрофильного соединения с появлением в итоге галогенопроизводного алкена. Также может появиться дигалогеналкан.
К примеру, когда ацетилен вступает в реакцию с хлороводородом, появляется хлорэтен. Потом уже создается 1,1-дихлорэтан.
\(CH\equiv{CH}+HCl\rightarrow{CH_{2}}=CHCl\)
\(CH_{3}=CHCl+HCl\rightarrow{CH_{3}}-CHCl_{2}\)
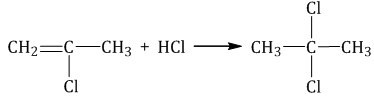
Когда галогеноводороды соединяются к веществам или же это делают иные молекулы с другим полюсом, получается один результат данного опыта, в рамках которого галогены располагаются рядом с атомом C. Если соединяются полярные молекулы к алкинам, которые не проявляют симметрию, формируется смесь изомеров. Однако в данном случае будет верно правило Марковникова.
Данное правило звучит примерно так: если соединяются молекулы, которые проявляют полярность, а их тип — НХ, с алкинами, которые не являются симметричными, водород в большинстве своем начнет вступать в реакцию к самому гидрогенизированному углеродному атому в случае двойной связи.
К примеру, если соединяются хлороводород HCl и пропин, то обычно формируется 2-хлорпропен.
Так это выглядит:
Источник: chemege.ru
Гидратация алкинов
Обычно данная реакция подразумевает, что в опыте используется вода. Она работает только с добавлением кислоты и катализирующего вещества (обычно это соль ртути II). Изначально происходит создание нестабильного спирта алкена, он позже начинает превращаться в изомер — кетон или же альдегид.
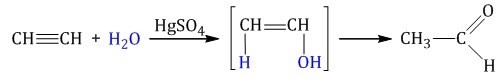
К примеру, в процессе соединения ацетилена и воды, а также добавления в реакцию сульфата ртути, формируется уксусный альдегид.
Это выглядит так:
Источник: chemege.ru
Обычно гидратация алкинов совершается по электрофильной схеме. Если алкены не обладают симметрией, вода будет соединяться с ними, согласно правилу Марковникова. К примеру, в процессе гидратации пропина будет формироваться пропанон.
Это выглядит так:
Источник: chemege.ru
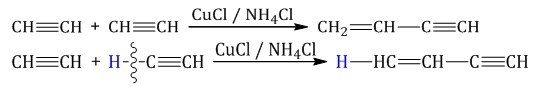
Димеризация, полимеризация, тримеризация
Соединение молекул ацетилена, то есть димеризация, происходит под воздействием раствора аммиака хлорида меди (I). В итоге будет создан винилацетилен:
Это выглядит так:
Источник: chemege.ru
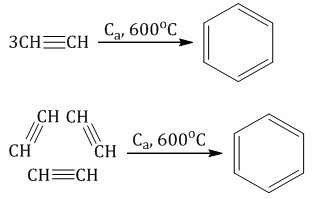
Соединение трех молекулярных структур (или же тримеризация) совершается только под влиянием нужной температуры. Также на реакцию должно воздействовать соответствующее давление и нужно добавить в реакцию активированный уголь. При этом будет создан бензол. Данную реакцию называют реакцией Зелинского.
Это выглядит так:
Источник: chemege.ru
Алкины принимают непосредственное участие в полимеризационной реакции. Этим процессом называют объединение молекул несколько раз подряд. При этом молекулы должны быть от вещества, в котором не так много молекул. В результате создается полимер, то есть вещество с большим количеством молекул.
\(nM\rightarrow^M_{n}\) (показатель M является мономерной молекулой). К примеру, в процессе полимеризации ацетилена создается полимер с структурой в линию или цикл.
Как получают алкины
Первый способ получить алкин — дегидрирование вещества. В случае дегидрирования алканов, которые хранят в себе примерно 2-3 углеродных атома в молекулах, формируются тройные и двойные связи.
К примеру, в случае, если дегидрировать этан, то может получиться ацетилен или же этилен.
\(CH_{3}-CH_{3}\rightarrow^{Ni, t}CH_{2}=CH_{2}+H_{2}\)
\(CH_{3}-CH_{3}\rightarrow^{Ni, t}CH_{2}\equiv{CH+2H_{2}}\)
Второй способ получить алкин — пиролиз метана. Данный вариант используется особо широко в промышленности для того, чтобы создать ацетилен. \(2CH_{4}\rightarrow^{1500^\circ{C}}HC\equiv{CH+3H_{2}}\). Реакция происходит достаточно стремительно. Обычно он проходит так: метан за доли секунду пропускают между электродами (обычно этот способ также именуется электродуговым). Данную реакцию проводят за 0,01 секунду, при этом температура для реакции не должна быть ниже \(1500^{\circ}\). В случае продления реакции, метан станет разлагаться на водород и углерод:
\(CH_{4}\rightarrow^{1500^\circ{C}}C+2H_{2}\)
Третьим способом для получения алкина является гидролиз карбида кальция. Данный способ используется в различных лабораториях для того, чтобы получить ацетилен. Так, обычно проводят гидролиз при помощи воды или кислот карбида кальция \(CaC_{2}\).
\(CaC_{2}+2H_{2}O=Ca(OH_{2})+C_{2}H_{2}\)
В рамках кислотной атмосферы происходит формирование ацетилена, а также подходящих солей: \(CaC_{2}+2HCl=CaCl_{2}+C_{2}H_{2}\).
Карбид кальция будет сформирован после нагревания оксида кальция вместе с добавлением углерода: \(CaO+ЗС(изб)\rightarrow{CaC_{2}}+CO\).
Четвертый способ получить алкин — дегидрогалогенировать дигалогеналкан.
У молекул дигалогеналканов находится два галогенных атома, которые располагаются в разных случаях либо у одного, либо у ближайших стоящих рядом углеродных атома. Они проявляют избыточную реакцию щелочного раствора спирта с формированием алкинов.
К примеру, вот такая реакция формируется, когда 1,2-дихлорпропан вступает в реакцию с раствором спирта гидроксида натрия: \(CH_{2}Cl-CHCl-CH_{3}+2NaOH\rightarrow^{C_{2}H_{5}OH}HC\equiv{C}+2NaCl+2H_{2}O\)
Пятый способ получить алкин — алкилировать сочетание алкина и металла. Например, пропиниды, ацетилениды и иные сочетании алкинов с металлическими веществами вступают в реакцию с галогеналканами, при этом формируется гомолог алкины. Также в данном случае можно наблюдать, что изначальная алкиная молекула становится длиннее.
К примеру, пропинид натрия вступает в реакцию с бромэтаном, при этом создается пентин-2.
\(CH_{3}-C\equiv{CNa}+Br-CH_{2}-CH_{3}\rightarrow{CH_{3}}-C\equiv{C}-CH_{2}-CH_{3}+NaBr\)
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так