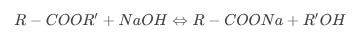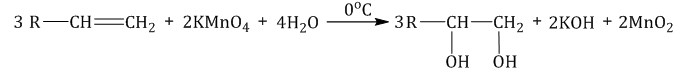Процесс получения спирта — основные методы
Процесс получения спирта — особенности процесса
В класс спиртов включены разнообразные органические соединения. Вещества в богатом ассортименте распространены в природном мире, активно используются в промышленности благодаря уникальным химическим свойствам.
Спиртами называют соединения, в состав которых включена одна или более гидроксильных групп –ОН, обладающих связями с углеводородным радикалом.
С течением времени было открыто множество понятных методов и технологий синтеза спиртов. Существует условная классификация способов получения этих соединений:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
- с помощью химических реакций получают синтетические спирты;
- биохимические методики позволяют синтезировать биоспирты.
Какие методы применяются на производстве, классификация химических реакций
Спирты занимают одну из лидирующих позиций в области органической химии. Вещества данного типа синтезируют из многих других соединений. Наиболее распространены на практике такие продукты для получения спиртов, как:
- алкилгалогениды, подвергаемые реакциям щелочного гидролиза, либо участвующие в химическом взаимодействии с супероксидом калия;
- алкены используют для реализации метода кислотной гидратации, реакции гидроксимеркурирования-демеркурирования или гидроборирования для дальнейшего окисления, применяют в промышленном оксо-синтезе;
- карбонильные соединения используют в восстановительных реакциях, либо для осуществления химических процессов при участии реактивов Гриньяра.
Получение спиртов из алкенов
Впервые спирты получили синтетическим способом путем кислотной гидратации алкенов. Способ можно рассмотреть на примере реакции электрофильного присоединения AdE2:
\({\mathsf {H_{2}O+HX}}\rightarrow {\mathsf {H_{3}O^{+}+X^{-}}}\)
\({\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+H_{3}O^{+}}}\rightleftarrows {\mathsf {[R\!\!-\!\!CH^{+}\!\!-\!\!CH_{3}]+H_{2}O}}\rightarrow {\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}+H^{+}}}\)
Механизм реализован, согласно правилу Марковникова. Роль катализаторов могут играть:
- серная кислота;
- смесь из муравьиной и каталитического количества серной кислоты;
- смесь муравьиной и хлорной кислоты;
- трифторуксусная кислота.
В результате реакции вторичных алкенов образуются смеси продуктов, усложняющие синтез вторичных спиртов:
\({\mathsf {CH_{3}(CH_{2})_{3}CH\!\!=\!\!CH_{2}+H_{2}O}}\ {\xrightarrow[{85-100^{o}C}]{HCOOH,\ HClO_{4}}}\ \ {\mathsf {CH_{3}(CH_{2})_{3}CH(OH)CH_{3}+CH_{3}(CH_{2})_{2}CH(OH)CH_{2}CH_{3}}}\)
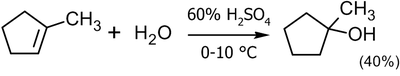
Кислотную гидратацию редко используют в лабораторных условиях. Как правило, подобным образом получают третичные спирты с выходом до 45 %:
\({\mathsf {(}}{CH_{3})_{2}C\!\!=\!\!CH_{2}+H_{2}O}\ {\xrightarrow[{10-20^{o}C}]{65\%H_{2}SO_{4}}}\ \ {\mathsf {(CH_{3})_{2}C(OH)CH_{3}}}\ _{(45\%)}\)
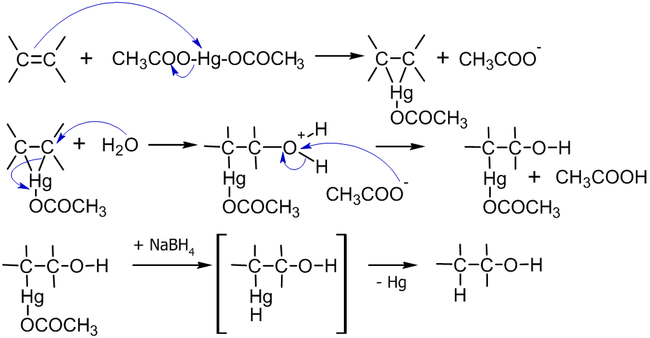
Механизм кислотной гидратации:
В промышленности повысить выход спиртов до 95 % позволяет метод прямой газофазной гидратации алкенов:
\({\mathsf {CH_{2}\!\!=\!\!CH_{2}+H_{2}O}}\ {\xrightarrow[ {300^{o}C,\ 70-80\ ATM}]{H_{3}PO_{4}/SiO_{2}}}\ \ {\mathsf {CH_{3}CH_{2}OH}}\)
\({\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+H_{2}O}}\ {\xrightarrow[ {200^{o}C,\ 20-30\ ATM}]{H_{3}PO_{4}/SiO_{2}}}\ \ {\mathsf {CH_{3}CH(OH)CH_{3}}}\)
Гидроксимеркурирование–демеркурирование алкенов осуществляется по следующей схеме:
На практике технология реализуется таким образом:
\({\mathsf {CH_{3}(CH_{2})_{3}CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{2)\ NaBH_{4};\ H_{2}O}]{1)\ (CH_{3}COO)_{2}Hg,;\ THF-H_{2}O;\ 20^{o}C}}\ \ {\mathsf {CH_{3}(CH_{2})_{3}CH(OH)CH_{3}}}\ _{(99,5\%)}\)
\({\mathsf {C_{6}H_{5}\!\!-\!\!C(CH_{3})\!\!=\!\!CH_{2}}}\ {\xrightarrow[{2)\ NaBH_{4};\ H_{2}O}]{1)\ (CH_{3}COO)_{2}Hg,;\ THF-H_{2}O;\ 20^{o}C}}\ \ {\mathsf {C_{6}H_{5}\!\!-\!\!C(CH_{3})(OH)\!\!-\!\!CH_{3}}}\ _{(100\%)}\)
\({\mathsf {(CH_{3})_{3}C\!\!-\!\!CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{2)\ NaBH_{4};\ H_{2}O}]{1)\ (CH_{3}COO)_{2}Hg,;\ THF-H_{2}O;\ 20^{o}C}}\ \ {\mathsf {(CH_{3})_{3}C\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}}}\ _{(97\%)}\)
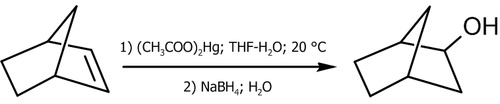
Вода присоединяется к нонборнену по механизму:
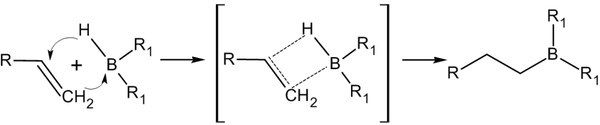
Гидроборирование алкенов с последующим окислением :
Уравнение реакции присоединения борана к алкенам:
\({\mathsf {3NaBH_{4}+4BF_{3}\cdot (C_{2}H_{5})O}}\rightarrow {\mathsf {2B_{2}H_{6}+3NaBF_{4}+4(C_{2}H_{5})O}}\)
Реакция гидроборирования представляет собой процесс син-присоединения. По итогам химического взаимодействия получают цис-аддукты. Уравнения реакций, протекающих в практических условиях:
\({\mathsf {RCH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{B_{2}H_{6}}}\ \ {\mathsf {RCH_{2}\!\!-\!\!CH_{2}OH}}\ _{(94\%)}+{\mathsf {RCH(OH)\!\!-\!\!CH_{3}}}\ _{(6\%)}\)
\({\mathsf {C_{6}H_{5}CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{B_{2}H_{6}}}\ \ {\mathsf {C_{6}H_{5}CH_{2}\!\!-\!\!CH_{2}OH}}\ _{(80\%)}+{\mathsf {C_{6}H_{5}CH(OH)\!\!-\!\!CH_{3}}}\ _{(20\%)}\)
\({\mathsf {(CH_{3})_{2}CHCH\!\!=\!\!CHCH_{3}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{B_{2}H_{6}}}\ \ {\mathsf {(CH_{3})_{2}CHCH_{2}CH(OH)CH_{3}}}\ _{(57\%)}+{\mathsf {(CH_{3})_{2}CHCH(OH)CH_{2}CH_{3}}}\ _{(43\%)}\)
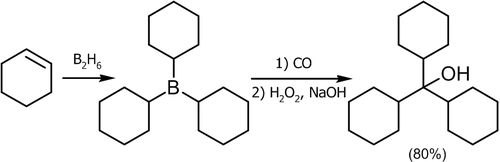
Гидроборирование алкенов сопровождается дальнейшим присоединением окиси углерода. Наиболее популярным методом синтеза третичных спиртов служит присоединение окиси углерода к алкилборанам:
\({\mathsf {3RCH\!\!=\!\!CH_{2}+BH_{3}^{-}O^{+}(-CH_{2}CH_{2})_{2}}}\rightarrow {\mathsf {(RCH_{2}\!\!-\!\!CH_{2}-)_{3}B+O(-CH_{2}CH_{2})_{2}}}\)
\({\mathsf {(RCH_{2}\!\!-\!\!CH_{2}-)_{3}B+CO}}{\xrightarrow {125^{o}C}}{\mathsf {[(RCH_{2}\!\!-\!\!CH_{2}-)_{3}B^{-}\!\!\!\!-\!\!C}}\!\!\equiv \!\!{\mathsf {O^{+}]}}\rightarrow {\mathsf {[(RCH_{2}\!\!-\!\!CH_{2}-)_{2}B\!\!-\!\!CO\!\!-\!\!CH_{2}CH_{2}R]}}\rightarrow\)
\({\mathsf {[(RCH_{2}\!\!-\!\!CH_{2}-)_{3}C\!\!-\!\!B\!\!=\!\!O]}}{\xrightarrow[ {NaOH,\ H_{2}O}]{H_{2}O_{2}}}{\mathsf {(RCH_{2}\!\!-\!\!CH_{2}-)_{3}COH+Na[B(OH)_{4}]}}\)
Описанный способ характеризуется высоким выходом со многими алкенами:
\({\mathsf {CH_{3}CH\!\!=\!\!CHCH_{3}}}{\xrightarrow[{3)\ H_{2}O_{2},\ NaOH,\ H_{2}O}]{1)\ B_{2}H_{6};\ 2)\ CO}}{\mathsf {(CH_{3}CH_{2}CH(CH_{3})-)_{3}COH}}\ _{(87\%)}\)
Уравнение реакции получения третичных спиртов с помощью присоединения СО к боранам:
Когда химическое взаимодействие, рассмотренное ранее, протекает при наличии водного щелочного раствора, результатом реакции являются вторичные спирты:
\({\mathsf {CH_{3}CH\!\!=\!\!CHCH_{3}}}{\xrightarrow {1)\ B_{2}H_{6};\ 2)\ CO;\ NaOH+H_{2}O}}{\mathsf {(CH_{3}CH_{2}CH(CH_{3})-)_{2}CHOH}}\)
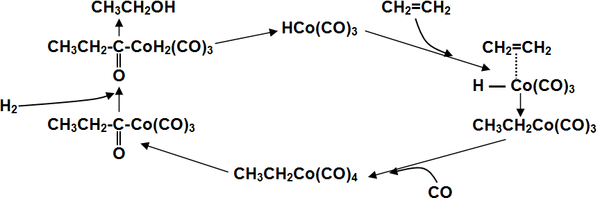
Распространенным промышленным способом синтеза спиртов является традиционная реакция гидроформилирования алкенов. Данный метод представляет собой каталитическое присоединение к алкенам водорода и монооксида углерода. На выходе получают альдегиды.
Возможен вариант реакции, который исключает образование промежуточных карбонильных соединений и сразу приводит к синтезу спиртов. Эту методику называют восстановительным гидроформилированием.
\({\mathsf {RCH\!\!=\!\!CH_{2}+CO+2H_{2}}}{\xrightarrow {Co_{2}(CO)_{8}}}{\mathsf {RCH_{2}CH_{2}CH_{2}OH+RCH(CH_{2}OH)CH_{3}}}\)
В процессе реакции образуется ненасыщенный гидрокарбонил кобальта, который играет роль координационного катализатора:
\({\mathsf {Co_{2}(CO)_{8}+H_{2}}}\rightleftarrows {\mathsf {2HCo(CO)_{4}}}\)
\({\mathsf {HCo(CO)_{4}}}\rightleftarrows {\mathsf {HCo(CO)_{3}+CO}}.\)
Циклично получение спирта на основе СО протекает таким образом:
Получение спиртов восстановлением эпоксидов и карбонильных соединений
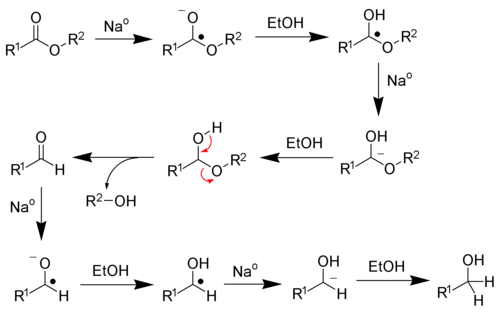
Реакция восстановления карбоновых кислот и сложных эфиров с помощью реакции Буво-Блана:
Карбоновые кислоты и сложные эфиры превращаются в спирты путем гомологизации. В процессе применяют реагенты в виде алюмогидрида лития.
Спирты получают при восстановлении эпоксидов и карбонильных соединений. При наличии в реакции катализаторов, таких как литийдиалкилкупраты, образуются молекулы спиртов, когда кольцевая структура эпоксидов разрывается.
Получение спиртов из карбоновых кислот и сложных эфиров
Синтез спиртов осуществляют в процессе стандартной реакции алифатического нуклеофильного замещения. Данный метод называют гидролизом сложных эфиров карбоновых кислот. Уравнение реакции:
\({\mathsf {R\!\!-\!\!COOR'+HO^{-}}}\rightarrow {\mathsf {R\!\!-\!\!COO^{-}+R'OH}}\)
В большинстве случаев для протекания данной реакции создают специальные условия, которые заключаются в нагреве и щелочном составе среды. На основе технологии построено промышленное производство глицерина из жиров растительного и животного происхождения.
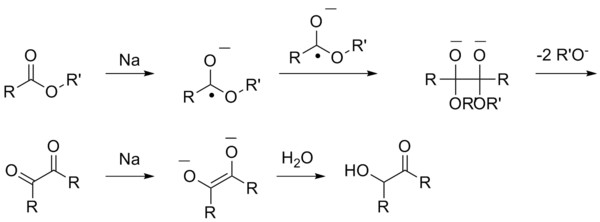
Другим методом получения спиртов является ацилоиновая конденсация. Образование \(\alpha\)-гидроксикетонов (ацилоинов) происходит за счет восстановления сложных эфиров с помощью металлического натрия:
Стадии реакции:
- образование анион-радикалов;
- трансформации алкоголятов;
- воздействие воды, сопровождающееся переходом в ацилоины.
Декарбонилирование карбоновых кислот является, по сути, отщеплением СО. Это наименее распространенный способ получения спиртов в лабораторных условиях. Химическая реакция протекает лишь при наличии металлических реагентов.
Получение спиртов с использованием металлорганических соединений
В качестве сырья для получения спиртов используют:
- карбоновые кислоты;
- производные карбоновых кислот;
- эфиры;
- кетоны.
С начальными компонентами вступают в химическое взаимодействие следующие вещества:
- металлоорганические соединения кадмия;
- металлоорганические соединения ртути;
- алюминия бромид;
- диалкилкупраты щелочных металлов.
Данный способ получил название реакции Гильмана. Роль растворителя в этом случае играет хлористый метилен. Для реализации метода требуется создать условия низких температур.
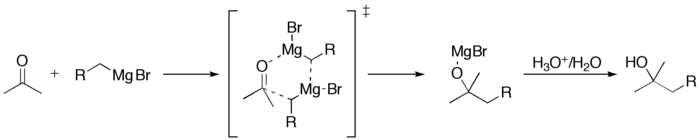
Другим способом синтеза спиртов является присоединение реактивов Гриньяра к альдегидам или кетонам:
Получение спиртов окислительными методами
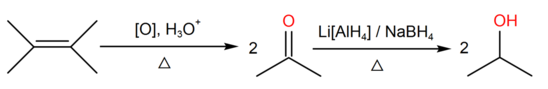
Многоатомные спирты синтезируют, используя методику, которая предполагает мягкое окисление (по Вагнеру) алкенов. Вещества пропускают через раствор окислителя и воды. В качестве такого материала можно использовать перманганат калия. Температура должна составлять от 0 °C до 5 °C:
Синтез вторичных спиртов осуществляют с помощью технологии жесткого окисления разветвленных алкенов. При этом используют подкисленный окислительный раствор или оксид осмия (VIII). Реакция сопровождается дальнейшим восстановлением:
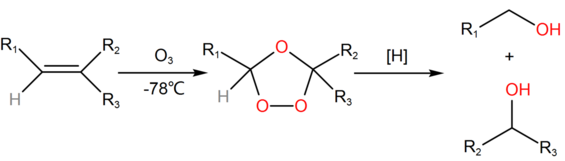
Озонирование алкена сопровождается последующим взаимодействием с сильным восстановителем, роль которого могут играть тетрагидроборат натрия и тетрадигидроалюминат лития. Схема реакции:
Реакцию озонолиза осуществляют с помощью органических растворителей, к примеру, хлористого метилена или этилацетата.
Высшие спирты синтезируют с применением алюминийорганических соединений. Данный метод называют реакцией Циглера. Алюминийорганические соединения получают из олефинов при наличии в среде водорода. Эта технология позволяет производить чистые первичные спирты:
\({\mathsf {RCH\!\!=\!\!CH_{2}}}\ {\xrightarrow[ {-RH}]{H_{2},\ AlR_{3}}}\ {\mathsf {RCH_{2}CH_{2}\!\!-\!\!AlR_{2}}}\ {\xrightarrow {O_{2}}}\ {\mathsf {RCH_{2}CH_{2}\!\!-\!\!O\!\!-\!\!Al(OR)_{2}}}\ {\xrightarrow {H_{2}O}}\ {\mathsf {RCH_{2}CH_{2}OH}}\)
Окисление катализаторов Гриньяра:
\({\displaystyle {\begin{array}{l}{\mathsf {R{-}MgX}}\quad +\quad {\mathsf {O2}}\quad \longrightarrow \quad {\color {Red}{\mathsf {R^{\bullet }+O_{2}^{\bullet {-}}}}}\quad +\quad {\mathsf {MgX^{+}}}\longrightarrow &{\mathsf {R{-}O{-}O{-}MgX}}&+\quad {\mathsf {H_{3}O^{+}}}&\longrightarrow \quad {\mathsf {R{-}O{-}O{-}H}}&+\quad {\mathsf {HO{-}MgX+H^{+}}}\\&\quad \ \ {\Bigg \downarrow }{\mathsf {R{-}MgX}}\\&{\mathsf {R{-}O{-}MgX}}&+\quad {\mathsf {H_{3}O^{+}}}&\longrightarrow \quad {\mathsf {R{-}O{-}H}}&+\quad {\mathsf {HO{-}MgX+H^{+}}}\end{array}}}.\)
Специфические способы, как это сделать в лаборатории
Существуют и другие методы получения спиртов. Рассмотрим некоторые из них. К примеру, алкены окисляют охлажденным раствором воды и перманганата калия. При этом алкены вступают в химическое взаимодействие с этим раствором без необходимости повышения температуры. В результате получают двухатомные спирты (гликоли):
В промышленности метанол синтезируют по технологии «синтез-газ». Каталитический метод получения метанола из монооксида углерода и водорода предполагает нагрев до 300–400 °С и поддержание давления в 500 атм. В реакции участвует смесь оксидов цинка, хрома и других веществ. В качестве сырья применяют смесь CO и H2 под названием «синтез-газ», обогащенную водородом. Уравнение реакции:
\(CO + 2H_{2} \rightleftarrows CH_{3}OH\)
Этанол получают в результате спиртового брожения глюкозы. В процессе ферментативного брожения молекулы, на которые действуют ферменты, распадаются. Пример реакции:
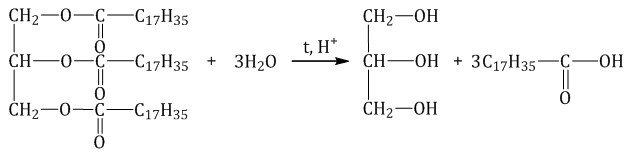
В результате гидролиза жиров получают многоатомные спирты. В процессе химического взаимодействия происходит гидролиз жиров, образуются глицерин и карбоновые кислоты, входящие в молекулу жира. В качестве примера можно записать формулу реакции гидролиза тристеарата глицерина, что приводит к образованию глицерина и стеариновой кислоты:
Щелочной гидролиз тристеарата глицерина сопровождается образованием глицерина и соли стеариновой кислоты под названием стеарат:
Спирты синтезируют с применением биотехнологического метода, то есть путем брожения. В качестве основного сырья при этом используют:
- древесину;
- сахар.
В лабораторных условиях синтез спиртов осуществляют следующими способами:
- гидратация алкенов с нагревом и при наличии концентрированной серной кислоты:
\(СН_{2} = СН_{2} + Н_{2}О \rightarrow СН_{3}ОН;\)
- гидролиз алкилгалогенидов, что сопровождается воздействием водных растворов щелочей:
\(СН_{3}Br + NaOH \rightarrow CH_{3}OH + NaBr\)
\(СН_{3}Br + Н_{2}О \rightarrow CH_{3}OH + HBr\)
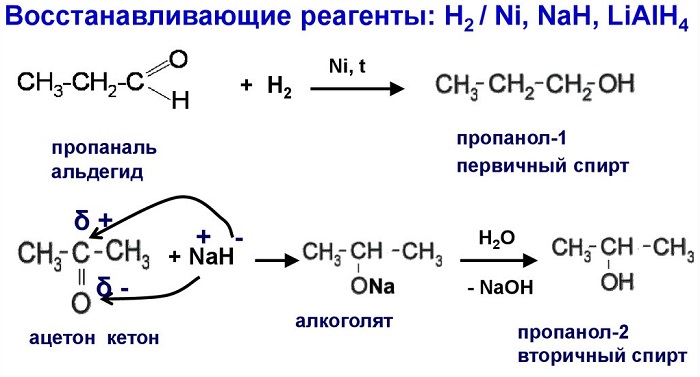
- восстановление карбонильных соединений:
\(CH_{3}-CH-O + 2[H] \rightarrow CH_{3}– CH_{2}-OH.\)
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так