Состав и особенности строения атомов хлора
Хлор — что это за элемент, общие сведения
Хлор является элементов в химии, которому присвоен атомный номер 17.
Элемент относят к 17 группе и 3 периоду таблицы Менделеева. Хлор активно применяют в промышленности и быту. Из простого класса вещество в обычных условиях имеет вид газа. Это яд желто-зеленой окраски. По сравнению с воздухом масса хлора больше. Вещество идентифицируют по специфическому и резкому запаху со сладким и металлическим привкусом.
Свойства атома хлора, его строение
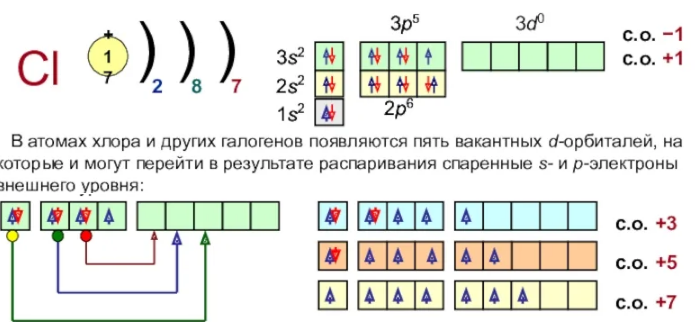
Хлор по конфигурации является неметаллом и причислен к категории галогенов. Для обозначения хлора используют буквенное сочетание Cl. Хлор обладает молекулой с двумя атомами. Вещество характеризуется молекулярной кристаллической решеткой. Запишем электронную формулу структуры:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
\(1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{5}\)
В хлорном атоме содержится ядро, заряд которого со знаком плюс и равен +17. По описанию окружают ядро 3 оболочки с перемещающимися электронами. Всего таких возможных частиц в системе 17 штук. Из них 10 принадлежат к внутреннему уровню состава. Соответственно 7 электронов можно обнаружить на внешнем уровне. Изобразить эту характеристику можно следующим способом:
Источник: theslide.ru
Физические и химические свойства
Ядовитый газ обладает особенностью удушающего эффекта и крайне опасен для человека. Рассмотрим основные физические свойства, характерные для хлора:
Источник: chem.ru
Хлор может вступать в химические реакции с металлами. В некоторых случаях для активного контакта требуется вода или повышенная температура.
\(\mathsf {2Na+Cl_{2}\rightarrow 2NaCl}\)
\(\mathsf {2Sb+3Cl_{2}\rightarrow 2SbCl_{3}}\)
\(\mathsf{2Fe + 3Cl_2 \rightarrow 2FeCl_3}\)
Вещество взаимодействует с неметаллами. Исключение составляют углерод, азот, фтор, кислород и газообразные вещества, являющиеся инертными. Результатом химической реакции является соответствующий хлорид.
\(\mathsf {5Cl_{2}+2P\rightarrow 2PCl_{5}}\)
\(\mathsf {2S+Cl_{2}\rightarrow S_{2}Cl_{2}}\)
\(\mathsf {S+Cl_{2}\rightarrow SCl_{2}}\)
Радиально-цепной принцип реакции характерен для смеси водорода и хлора, если обеспечить воздействие ультрафиолета или повышение температурного режима. В некоторых случаях такая ситуация сопровождается взрывом.
\(\mathsf {H_{2}+Cl_{2}\rightarrow 2HCl}\)
Отсутствует прямая реакция хлора с кислородом. В результате такого химического взаимодействия формируются оксиды. При контакте хлора и фтора можно наблюдать образование фторидов.
\(\mathsf {Cl_{2}+F_{2}\rightarrow 2ClF}\)
\(\mathsf {Cl_{2}+3F_{2}\rightarrow 2ClF_{3}}\)
\(\mathsf {Cl_{2}+5F_{2}\rightarrow 2ClF_{5}}\)
Если хлор растворить в водной или щелочной среде, то происходит диспропорция.
\(\mathsf {Cl_{2}+H_{2}O\rightleftarrows HCl+HClO}\)
\(\mathsf {Cl_{2}+2NaOH\rightarrow NaCl+NaClO+H_{2}O}\)
\(\mathsf {3Cl_{2}+6NaOH\rightarrow 5NaCl+NaClO_{3}+3H_{2}O}\) (в условиях повышения температурного режима)
При наличии в реакции кобальтовых солей можно наблюдать реакцию хлора с водной средой.
\(\mathsf {2H_{2}O+2Cl_{2}}\xrightarrow {h\nu ,\,{\textrm {CoCl}}_{3}} {\mathsf {4HCl+O_{2}}}\)
Если хлор взаимодействует с гидроксидом кальция в сухом состоянии, то в результате образуется хлорная известь.
\(\mathsf {Cl_{2}+Ca(OH)_{2}\rightarrow CaCl(OCl)+H_{2}O}\)
Хлор обладает достаточно мощными окислительными свойствами.
\(\mathsf {Cl_{2}+H_{2}S\rightarrow 2HCl\uparrow +S}\)
Хлор вступает в химическое взаимодействие с органикой. Если соединения являются насыщенными, то можно привести следующие примеры реакций:
\(\mathsf {CH_{3}{\text{-}}CH_{3}+Cl_{2}\rightarrow C_{2}H_{5}Cl+HCl}\)
\(\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}\)
Контакт хлора и ненасыщенных органических соединений реализован по кратным связям.
\(\mathsf {CH_{2}{\text{=}}CH_{2}+Cl_{2}\rightarrow Cl{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}Cl}\)
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так