Основные виды химических связей с примерами
Химическая связь — определение термина
Одним из важнейших понятий науки химии является, наряду с реакциями, понятие о химической связи. В этой статье будут рассмотрены такие моменты, как определение химической связи, ее типы и методы описания.
Химическая связь — это взаимодействие между атомами в молекуле и кристаллической решетке, которое возникает благодаря силе притяжения, существующей между атомами, и способствует устойчивости химической молекулы или кристаллической решетки. Получение различных химических соединений происходит из-за существования этой связи.
Первым описал идею подобных связей Э. Франкленд в 1852 году. Он предположил, что каждому элементу для образования связей необходимо определенное количество эквивалентов других элементов, и связал количество этих эквивалентов с понятием валентности. Но еще в 1845 году появилась электрохимическая теория Й. Берцелиуса, которая в то время не была признана большинством ученых. Й. Берцелиус считал все неорганические соединения состоящими из двух противоположно заряженных частей и сохраняющими целостность благодаря силам электрического притяжения. Классификация типов химической связи содержит четыре ее вида:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
- ионная;
- водородная;
- ковалентная;
- металлическая.
Основные понятия, характеристики
Атомы, у которых на внешних оболочках находится по восемь электронов, характеризуются повышенной устойчивостью и характерны для инертных газов — радона, неона, криптона, аргона. Из них выделяется гелий — на его оболочках находятся всего два электрона, что делает его еще более устойчивым.
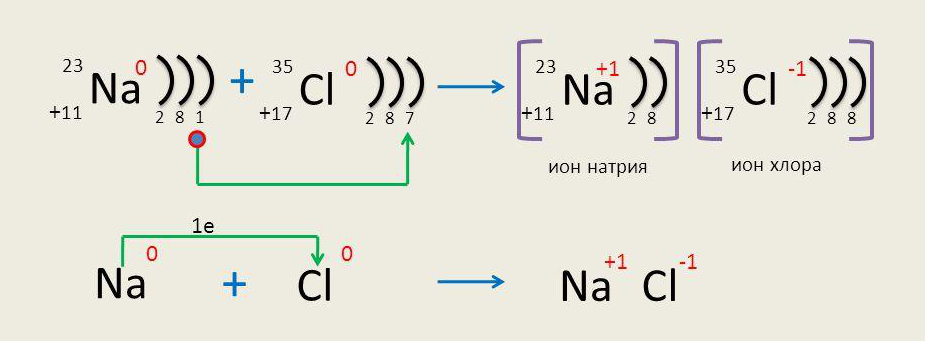
Атомы остальных веществ стремятся к получению такой устойчивости, достигая ее путем отдачи либо присоединения необходимого количества электронов. Например, атому хлора до идеальной конфигурации необходим один электрон, который он стремится приобрести. А атому натрия, на внешних оболочках которого находится всего один электрон, выгоднее его отдать и стать заряженным ионом с электронной конфигурацией газа неона.
Из описанного выше выводится такая характеристика, как электроотрицательность — способность атомов притягивать электроны. Чем эта характеристика сильнее, чем больше элемент притягивает электронов, тем ярче проявляются окислительные свойства вещества.
Химические связи образуются по одному из двух механизмов:
- обменный механизм основан на том, что атомы веществ обобществляют неспаренные электроны;
- донорно-акцепторный механизм основан на том, что атом-донор предоставляет свободную пару электронов, а атом-акцептор — свободную орбиталь, на которую и закрепляются электроны другого вещества.
Другими характеристиками химических связей являются:
- длина — равновесное расстояние между атомами, измеряемое экспериментально;
- энергия — характеристика, описывающая прочность связи, усилие, которое надо приложить, чтобы разорвать ее;
- порядок, или кратность — характеристика, показывающая, сколько электронных пар вступило в реакцию, чем их больше — тем связь сильнее.
Типы химических связей, примеры с пояснениями
Ионная химическая связь
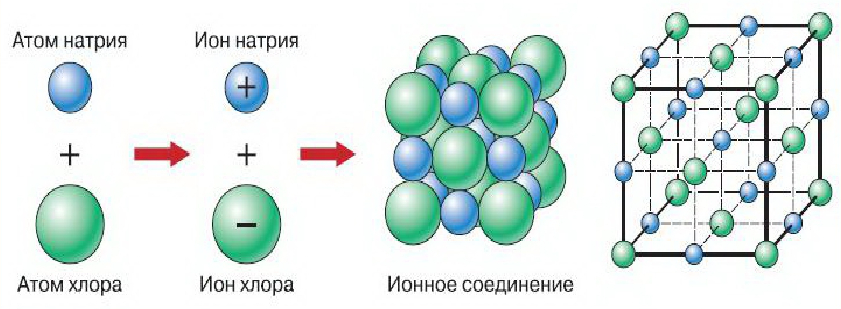
Ионная химическая связь возникает за счет притяжения разных по полярности зарядов ионов.
Ионы — это заряженные частицы, которые образуются за счет отдачи или приема электронов атомами.
Рассмотрим возникновение ионной связи на примере хлора и натрия.
Электрическое поле ионов действует во всех направлениях, каждый положительный ион окружен отрицательными ионами, поэтому их соединение представляет собой четко структурированную огромную группу. За счет силы ионной связи такие вещества имеют высокие температуры плавления и кипения.
Вещества с ионной связью: пищевая сода, поваренная соль, медный купорос.
Водородная химическая связь
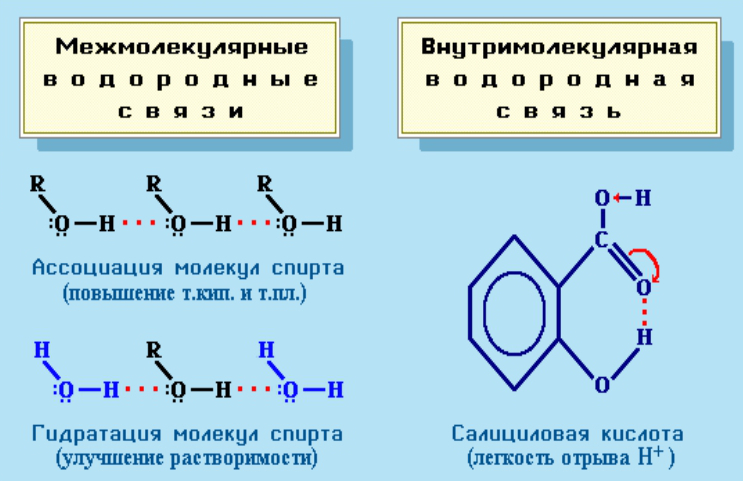
Водородная химическая связь, или Н-связь, возникает между положительно заряженным атомом водорода и отрицательно заряженным атомом другого вещества. Подразделяется на междумолекулярную и внутримолекулярную.
Междумолекулярная возникает между молекулами вещества, а внутримолекулярная — внутри молекулы, между ее составляющими. Водородная связь наблюдается у многоатомных спиртов, белков, углеводов и некоторых других органических соединений.
Понятие и термин «водородная связь» были введены в науку в 1920 году для объяснения высоких температур кипения воды, спиртов и некоторых других соединений В. Латимером и Р. Родебушем.
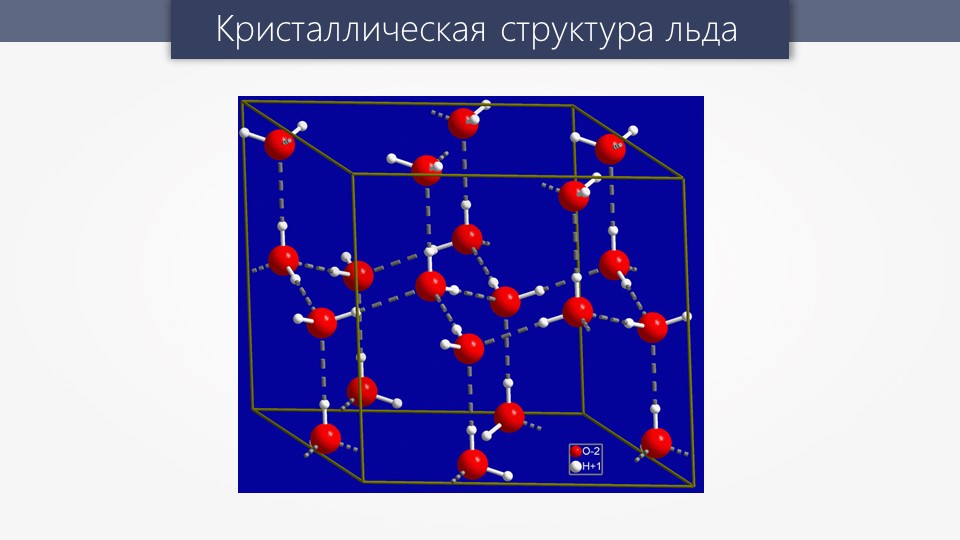
Н-связи не только увеличивают температуру кипения, но и проявляют себя в строении кристаллической решетки вещества. В качестве примера рассмотрим строение кристаллической решетки льда — оно таково, что расстояние между отдельными атомами довольно велико, за счет чего лед держится на поверхности воды, что влияет на экологию водных ресурсов — рыбы и другие водные жители существуют благодаря этому удивительному свойству водородных связей.
Большую роль играет водородная связь и в биологии, так как знаменитая двойная спираль ДНК имеет между нуклеотидами двух цепочек ДНК аденин-тимин — двойную Н-связь, а гуанин-цитозин — тройную. Это понятно по приведенной ниже схеме.
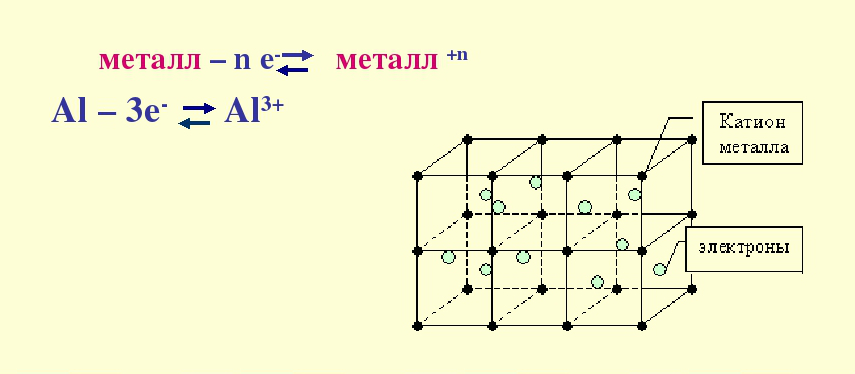
Химическая связь металлов
Металлическая связь — это связь, возникающая между положительными ионами и атомами металлов посредством свободных электронов.
Такая связь возможна из-за особенностей строения атомов металлов — у них большие радиусы между орбиталями и сравнительно небольшое количество электронов на внешнем уровне. Электроны легко отрываются, превращая атом в положительно заряженный ион. Потом свободные электроны легко перемещаются к другому иону, прикрепляясь к нему и превращая его в атом. Затем цикл повторяется.
За счет этого все металлы обладают сходными свойствами — твердость, большая тепло- и электропроводность, характерный металлический блеск, ковкость. Этими характеристиками обладают как чистые металлы, такие как железо, медь, золото, алюминий, так и их сплавы — бронза, дюралюминий и другие.
Как определить вид химической связи
Вид определяется по веществам, участвующим в реакции:
- если взаимодействуют два металла, то эта связь металлическая;
- если в реакции участвуют металл и неметалл, то связь будет ионная;
- в случае взаимодействия двух неметаллов связь между ними будет ковалентная.
Методы описания связей
Известно несколько способов описания:
- Метод валентных связей, сокращенно МВС, или теория локализованных электронных пар. Второе название связано с тем, что химическая связь между атомами происходит за счет одной или нескольких электронных пар, располагающихся между ними. Число этих связей определяется валентностью атома. Простейшая химическая связь в МВС всегда двухатомная и двухцентровая, осуществляется за счет валентных электронов.
- Метод молекулярных орбиталей, сокращенно ММО. Этот метод построен на предположении, что состояние электронов в молекуле можно описать как совокупность молекулярных электронных облаков (орбиталей). Для получения молекулярных орбиталей необходимо, чтобы атомные орбитали имели примерно равные энергии, заметно перекрывались и обладали одинаковой симметрией относительно образуемой химической связи.
Имеющиеся методы описания равнозначны и дополняют друг друга.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так