Внутренняя энергия в термодинамике
Что такое внутренняя энергия в термодинамике
Термодинамика — раздел физики, изучающий наиболее общие свойства макроскопических систем и способы передачи и превращения энергии в таких системах.
Изучением тепловых характеристик тел и систем, в которых присутствует тепловое равновесие, занимается термодинамика. В основе ее принципа лежит закон сохранения энергии, а также взаимосвязи, возникающие между такими физическими величинами, как давление, температура, объем. В термодинамике не изучаются тепловые процессы, происходящие на микроскопическом уровне.
История изучения
Введение в перечень физических явлений понятия «работа в термодинамике» принадлежит инициативе нескольких ученых. Так, М.В. Ломоносов утверждал, что возникновение внутри тела тепла происходит благодаря внутреннему движению частиц определенной материи. По его мнению, именно поэтому нагреваются руки, если их потереть друг об друга, или нагреется кусок железа при его интенсивной ковке.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Б. Румфорд обнаружил, что сверлении ствола для пушек вызывает нагревание металла. Он подтверждал свои наблюдения таким экспериментом: помещал цилиндр из металла в емкость с водой и сверлил в нем отверстие. При этом было реальным довести воду в емкости до кипения в течение двух с половиной часов.
Аналогичными исследованиями занимался Дэви. Из двух кусков льда в результате их трения друг о друга он получал талую воду.
Экспериментальных подтверждений появления внутренней энергии в результате усиления движения частиц, науке известно много. Так, Роберт Майер, будучи поваром на корабле, еще в 1840 году поделился своими наблюдениями, что по окончании шторма вода в море имеет более высокую температуру, чем до его развития.
Приведенные факты подтверждают, что при перемещении внутренних частиц в макроскопическом теле образуется энергия. Она не заставляет тело передвигаться в пространстве. Однако его объем и температура значительно преображаются.
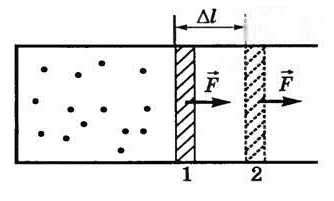
Для наглядности рассмотрим пример с движущимся внутри цилиндра поршнем. При его поступательном движении кинетическая энергия передается находящемуся внутри газу. В результате этого газ сжимается, а его молекулы начинают двигаться быстрее, вызывая повышение температуры. Наоборот, при движении поршня в обратном направлении, количество передаваемой энергии уменьшается, объем газа и межмолекулярные расстояния увеличиваются, происходит остывание.
Способы изменения внутренней энергии
Для любой термодинамической системы свойственен определенный запас энергии. Ее общая величина определяется суммой различных видов, например, тепловой, ядерной, химической и т.п.
Энергию замкнутой термодинамической системы называют внутренней. Для ее расчета учитывается ее равенство нулю при каком-либо фиксированном состоянии.
Можно ли изменить первоначально заложенную внутреннюю энергию? Для этого существует два пути:
- Совершить работу.
- Осуществить передачу тепла извне.
Понятно, что при совершении работы самим телом, на нее расходуется часть энергии, поэтому ее запас уменьшится. Наоборот, во время совершения работы над телом, ему передается энергия извне, увеличивая ее собственный запас. Оба процесса инициируют переход энергии из механической во внутреннюю либо наоборот.
Исходя из особенностей принятого за нулевое состояние, на определенном этапе суммарная энергия может являться отрицательным числом. Однако это не значит, что она носит минусовый характер. Правильнее ее оценить, как энергию, находящуюся на более низком уровне, чем принятая на ноль.
Когда внутренняя энергия уменьшается, тело в ходе теплопередачи теряет температуру. В тоже время, передача ему тепла ведет к увеличению внутренней энергии. Когда газ в цилиндре сжимается, его температура растет, а внутренняя энергия увеличивается. Расширение газа уменьшает его внутреннюю энергию и снижает температуру.
Внутренняя энергия может меняться и без совершения работы, а за счет переданного количества теплоты. Данная физическая величина имеет обозначение \(Q\) и измеряется в Дж.
Теплопередача подчиняется закону сохранения энергии: тело получает такое количество тепла, какое ему передает другое тело.
Эти два способа изменения внутренней энергии могут происходить параллельно. При этом обязательно изменяется температуры тела.
Определение изменения внутренней энергии происходит по формуле: \(U\;=\;Q\;-\;A \)
где \(U\) — внутренняя энергия, \(Q\) — теплота,\( А \)— работа.
Первый закон термодинамики, формула
Закон сохранения энергии, в котором утверждается, что в изолированной системе энергия является постоянной величиной, в физике называется первым законом термодинамики.
При отсутствии изоляции системы параметры энергии могут меняться, если:
- совершается работа;
- происходит теплообмен с внешней средой.
Объясняется это наличием энергетических потоков, циркулирующих между термодинамической системой и внешней средой. Когда тепло передается в адрес системы, Q становится больше нуля. Когда системой совершается определенная работа, то больше нуля становится работа А.
Первый закон термодинамики обобщает положения закона сохранения энергии и ее превращения в пределах термодинамической системы.
Изменение внутренней энергии \((ΔU)\) для неизолированной системы выражается разностью количества теплоты \(Q\), которое система получила, и \(А\) (работой, которая была ею проделана по отношению к другим телам).
\(\Delta U\;=\;Q\;–\;A\)
Существует и другой способ формульного выражения первого закона термодинамики: то количество теплоты, которое система получила, расходуется на изменение внутренней энергии, а также на совершаемую работу в отношении окружающих тел.
Его формула выглядит так:
\(Q\;=\;\Delta U\;+\;A\)
Понятие о внутренней энергии, введенное данной закономерностью, в качестве своей основы имеет утверждение, что \(U\) не бывает уничтоженной или созданной из ничего. Она превращается в разные свои формы при передаче между системами.
С учетом знания закона становится понятным, почему невозможны способы создания вечного двигателя без поступления энергии извне. Поскольку, совершая работу, тело теряет энергию, а без ее восполнения через какое-то время становится недееспособным.
Применение первого закона термодинамики
В изопроцессах, происходящих в газах, наблюдается полноценное действие первого закона термодинамики.
Изохорный процесс
Изохорный процесс — термодинамический процесс, который происходит при постоянном объёме.
V газа — величина постоянная. Поэтому A равна нулю. \(ΔU\) не отличается от Q. Следовательно, \(ΔU = Q\). При нагревании \(Q\) и \(ΔU\) увеличиваются. при охлаждении — обратный процесс.
Одноатомный газ характеризуется формулой:
\(Q=2/3\ast m/M\ast R\ast\Delta T\)
Отсюда показатель удельной теплоемкости газообразного вещества определяется по формуле:
\(Cv=Q/m\ast\Delta T=3R/2M\)
Изотермический процесс
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
При постоянном Т внутренняя энергия остается неизменной, а \(Q=A\). При \(Q\) больше, чем ноль, А также — положительная величина. Когда происходит отдача газа энергии окружающей среде, \(Q\) и \(А\) меньше нуля. Зато положительной является работа внешних сил.
В этой ситуации удельная теплоемкость газа стремится к ∞.
Изобарный процесс
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянных давлении и массе газа.
\(Q=\Delta U+A=\Delta U+p\Delta V\)
При постоянном давлении передаваемое количество теплоты расходуется на совершение работы и изменение внутренней энергии.
Адиабатный процесс
Адиабатный процесс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
Например, если газ в сосуде, теплоизолированном от внешней среды, самостоятельно расширяется, работа, которую он совершает, является положительной.
Так как, в соответствии c I-м законом термодинамики, теплота, сообщенная системе (или газу) расходуется на совершение работы или меняет ее внутреннюю энергию. В случае адиабатного процесса сообщаемая теплота отсутствует, работа сравнивается с разницей внутренней энергии (с противоположным знаком).
В формуле это выглядит так: \(А'\;=\;-\Delta U\;(Q\;=\;0)\)
При расширении газа работа совершается им за счет уменьшения внутренней энергии: \(А'\;>\;0,\;\Delta U\;<\;0.\)
Поскольку показателем расхода внутренней энергии является снижение температуры, наблюдается реакция охлаждения газа.
Если внешняя сила совершает работу по сжиманию газа, внутрення энергия увеличивается. При этом температура газа повышается (при условии, что процесс адиабатный, удельная теплоемкость газа равна нулю).
Наблюдать особенности адиабатного процесса можно в основе работы дизельных двигателей. При отсутствии системы зажигания в цилиндр попадает атмосферный воздух. На последних этапах его сжатия в цилиндр с помощью форсунки впрыскивается топливо.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так