Двухатомные спирты
Двухатомные спирты (гликоли, или диолы) — что это за соединения
Спирты представляют собой класс органических веществ, в состав которых входит одна или несколько гидроксильных групп (—OH), связанных с атомом углерода (C) в углеводородном радикале (R—OH).
Двухатомные спирты (диолы, или гликоли) — органические соединения, содержащие в структуре молекулы две гидроксильные группы.
Основные формулы с примерами
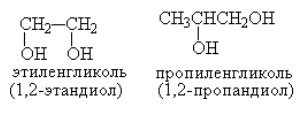
Основные формулы гликолей:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
\({\mathrm C}_n{\mathrm H}_{2n}{(\mathrm{OH})}_2\) или \({\mathrm C}_n{\mathrm H}_{2n+2}{\mathrm O}_2\)
Диолы легко выстраиваются в гомологический ряд, сформулировать который можно с помощью гомологического ряда насыщенных углеводородов, заменяя в структуре их молекул два атома водорода на OH-группы.
Номенклатура гликолей
В номенклатуре ИЮПАК для названия двухатомных спиртов вместо окончания «-ол» используют «-диол» (пропандиол, этандиол и т. д.), а цифрами обозначают атомы углерода главной цепи, к которым присоединены две группы (OH).
1,2-этандиол (этиленгликоль), 1,3-пропандиол, 1,2-пропандиол (пропиленгликоль), транс-1,2-циклогександиол и т. д.
Подобная систематическая номенклатура осуществляет дифференциацию 1,2-, 1,3-, 1,4-диол, т. к. от взаимного расположения OH-групп зависят химические и физические свойства веществ.
Пропиленгликоль представлен двумя изомерами:
1,2-пропандиолом
\({\mathrm{CH}}_3-\mathrm{CHOH}-{\mathrm{CH}}_2-\mathrm{OH}\)
1,3-пропандиолом
\(\mathrm{HO}-{\mathrm{CH}}_2-{\mathrm{CH}}_2-{\mathrm{CH}}_2-\mathrm{OH}\)
При этом способность к вступлению в химическую реакцию и склонность к полимеризации у 1,2-пропиленгликоля выражены в меньшей степени, чем у 1,3-пропиленгликоля.
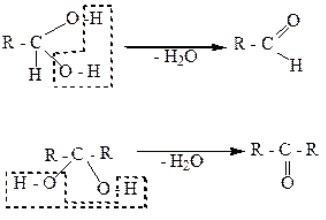
Гликоли, в структуре которых гидроксильные группы находятся возле разных атомов углерода, являются устойчивыми:
Геминальные диолы содержат две OH-группы возле одного углеродного атома, что обуславливает их неустойчивость. Такие гликоли легко разлагаются. В результате за счет гидроксильных групп отщепляется вода, и образуются альдегиды или кетоны:
Физические свойства гликолей
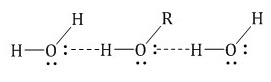
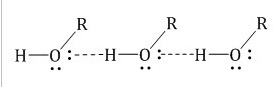
Гликоли чаще всего представляют собой густые, бесцветные, жидкости малой летучести, без запаха. Хорошо смешиваются с водой (особенно низшие диолы) и органическими растворителями (спиртами, кетонами, кислотами и аминами). Высокий показатель растворимости в воде объясняется образованием водородных связей между молекулами воды и спиртов — гидратацией:
Для всех спиртов характерно образование межмолекулярных водородных связей, вызывающих притяжение и ассоциацию молекул спиртов:
Из-за наличия двух гидроксильных групп диолы имеют более высокую температуру кипения и плотность в сравнении с соответствующими им одноатомными.
Этиленгликоль имеет температуру кипения 197 °C, плотность — 1,113 г/см3, а этанол закипает при 78 °C, плотность имеет, равную 0,789 г/см3.
Большинство диолов имеют сладкий, а некоторые — горьковатый вкус.
Химические свойства гликолей и их применение
Гликоли участвуют в тех же химических реакциях, что и одноатомные спирты, но отличаются тем, что в реакцию вводится либо одна, либо обе спиртовые группы. Поэтому у них бывают два ряда производных: полные и неполные.
При взаимодействии этиленгликоля с натрием (Na) получаются гликоляты:
\({\mathrm{CH}}_2(\mathrm{OH})-{\mathrm{CH}}_2(\mathrm{ONa})\;\mathrm и\;{\mathrm{CH}}_2(\mathrm{ONa})-{\mathrm{CH}}_2(\mathrm{ONa}).\)
При этом водород в диолах замещается легче, чем в одноатомных спиртах.
Химические свойства:
- Кислотные свойства двухатомных спиртов более активны, чем у одноатомных по причине воздействия гидроксильных групп друг на друга. Данное химическое свойство дуолов указывает на их способность реагировать со щелочами, щелочными металлами и гидроксидами тяжелых металлов, что недоступно одноатомным спиртам. Реакция при взаимодействии с гидроксидами тяжелых металлов (меди, например) является качественной на двухатомные спирты.
- Дуолы имеют способность образования полных и неполных простых и сложных эфиров. Полученные в таких реакциях метил- и этилцеллозольвы используют в качестве растворителей при производстве лаков и бездымного пороха, а сложный эфир динитроэтиленгликоль — вместо нитроглицерина из-за его мощной взрывоопасности (кроме того, он летуч и крайне ядовит).
- Реакция окисления дуолов происходит в несколько этапов, с образованием ряда промежуточных (гликолевый альдегид, глиоксаль, гликолевая кислота, глиоксиловая кислота) и конечного (щавелевая кислота) результатов. По полученным продуктам (как и у одноатомных спиртов) можно судить о структуре вступившего в реакцию гликоля.
- Гликоли вступают в химическую реакцию дегидратации, в которой вода отщепляется в зависимости от расположения гидроксильных групп диолов. Дегидратация может происходить как внутри-, так и межмолекулярно.
В результате межмолекулярного отсоединения воды в реакции по перегону этиленгликоля с серной кислотой \(({\mathrm H}_2{\mathrm{SO}}_4)\) получается циклический простой эфир — диоксан, применяемый затем как растворитель.
С помощью реакции гидратации получают этиленгликоль — самый простой двухатомный спирт и самое востребованное химическое соединение в промышленности и быту.
Этиленгликоль (1,2-этандиол, 1,2-диоксиэтан) — органическое соединение, простейший двухатомный спирт. Представляет собой жидкость без цвета и запаха, прозрачную и немного маслянистую со сладковатым вкусом. Легковоспламеняемый и токсичный (3-й класс опасности).
Химическая формула этиленгликоля:
\(\mathrm{HO}-{\mathrm{CH}}_2-{\mathrm{CH}}_2-\mathrm{OH}\\\)
Способность этиленгликоля понижать температуру замерзания воды нашла широкое применение в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Из-за коррозийной активности применяется с ингибиторами.
Благодаря высокой гигроскопичности этиленгликоль используется в растворении и изготовлении красок для печати, производстве чернил для шариковых ручек и т. д. Крайне популярен этиленгликоль в производстве пленкообразующих материалов, лаков, волокон (лавсана, например), в органическом синтезе простых и сложных эфиров.
Виды спиртов по характеру углеводородного радикала
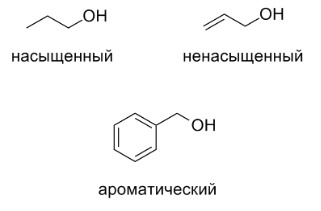
По структуре углеводородного радикала, связанного с атомом кислорода, спирты бывают следующих видов: предельные (насыщенные), непредельные (ненасыщенные), ароматические.
Предельные спирты
Предельные (насыщенные, алканолы) спирты — органические вещества, производные предельных углеводородов, в структуре которых атом водорода замещен на гидроксильную группу.
Метанол \(({\mathrm{CH}}_3-\mathrm{OH})\).
1-пропанол \(({\mathrm{СН}}_3-{\mathrm{СН}}_2-{\mathrm{СН}}_2-\mathrm{ОН})\).
1-бутанол \(({\mathrm{СН}}_3-{\mathrm{СН}}_2-{\mathrm{СН}}_2-{\mathrm{СН}}_2-\mathrm{ОН}).\)
Для предельных спиртов характерна:
- Структурная изомерия (1-пропанол: \({\mathrm{СН}}_3-{\mathrm{СН}}_2-{\mathrm{СН}}_2-\mathrm{ОН}\) ; 2-пропанол: \({\mathrm{СН}}_3-\mathrm{СН}(\mathrm{ОН})-{\mathrm{СН}}_3)\)).
- Межклассовая изомерия (этанол: \({\mathrm{СН}}_3-{\mathrm{СН}}_2\mathrm{ОН}\); диметиловый эфир: \({\mathrm{СН}}_3-\mathrm О-{\mathrm{СН}}_3\)).
Изомерия — явление различия химических и физических свойств веществ при идентичности их количественного и качественного состава.
Начиная с бутанола, прослеживается изомерия углеродного скелета (1-бутанол: \({\mathrm{СН}}_3-{\mathrm{СН}}_2-{\mathrm{СН}}_2-{\mathrm{СН}}_2-\mathrm{ОН}\); 2-метилпропанол-1: \({\mathrm{СН}}_3-\mathrm{СН}({\mathrm{СН}}_3)-{\mathrm{СН}}_2\mathrm{ОН}\)), при которой наименование спирта записывается с использованием двух цифр. Первая из них показывает положение метильной группы, вторая — гидроксильной.
Непредельные спирты
Непредельные (ненасыщенные) содержат кратные (двойные и тройные) межуглеродные связи:
- алкенолы — пропен-2-ол-1 (аллиловый спирт):
\({\mathrm{CH}}_2=\mathrm{CH}-{\mathrm{CH}}_2-\mathrm{OH}\)
- алкинолы — пропин-2-ол-1 (пропаргиловый спирт):
\(\mathrm{CH}\equiv\mathrm C-{\mathrm{CH}}_2\mathrm{OH}\)
Непредельные спирты подразделяются на два основных типа:
- спирты с гидроксильной группой, находящейся вблизи атома углерода, сцепленного двойной связью (виниловый спирт);
- спирты с гидроксильной группой, находящейся вблизи атома углерода, соседнего с двойной связью (аллиловый спирт).
Спирты первого типа неустойчивы и сразу же превращаются в соответствующие изомерные карбонильные соединения.
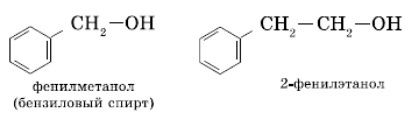
Ароматические спирты
Ароматические спирты являются производными жирноароматических углеводородов, имеющими в структуре фенильный радикал (производную от бензола), иными словами — ароматическое кольцо и гидроксильную группу, не связанные напрямую, а через атомы углерода.
К ароматическим спиртам относятся фенилметанол (бензиловый спирт) и 2-фенилэтанол.
Ароматические спирты не следует путать с фенолами, у которых группа (OH) связана с бензольным кольцом без посредников.
Дополнительная (внутренняя) классификация
Спирты также дифференцируют по следующим признакам.
В зависимости от местонахождения OH-группы в молекуле:
- Первичные — гидроксильная группа прикреплена к первому атому углерода.
- Вторичные — OH-группа расположена вблизи второго атома углерода.
- Третичные — гидроксильная группа присоединена к третьему атому углерода.
По числу OH-групп в молекуле соединения:
- Одноатомные — содержат одну гидроксильную группу.
- Многоатомные — включают две и более гидроксильные группы.
По количеству углеродных атомов в структуре молекулы спирта:
- Низшие — содержат от 1 до 10 атомов углерода.
- Высшие — включают более 11 атомов углерода.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так