Кислород
Что такое кислород — история открытия, значение в природе
Кислород — химический элемент 16-й группы, второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым легким элементом из группы халькогенов.
Химический элемент кислород был открыт Джозефом Пристли в 1774 году.
Ученый с помощью линзы направил солнечные лучи на оксид ртути в герметично закрытом сосуде. В результате реакции разложения был выделен кислород:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
\(2HgO\;\xrightarrow t\;2Hg\;+\;O_2\uparrow.\)
Пристли не сразу понял, что открыл новое простое вещество. Своим открытием он поделился с французским химиком Антуаном Лавуазье, который на основе работ Петра Байена и Карла Шееле установил, что кислород — это самостоятельное вещество.
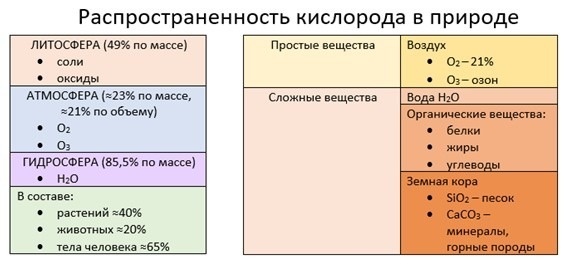
Кислород — самый распространенный на Земле элемент. Он входит в состав многих неорганических и органических веществ, содержится в большом количестве в литосфере, атмосфере и гидросфере, присутствует во все живых клетках.
Кислород входит в состав:
- силикатов;
- оксидов;
- гидроксидов;
- карбонатов;
- сульфатов;
- нитратов.
Эти вещества содержатся в почве, глинах, песке и горных породах.
В природе кислород образуется в процессе фотосинтеза, который происходит в зеленых растениях на свету. Под воздействием света растения вырабатывают из углекислого газа и воды глюкозу и кислород:
\(6CO_2\;+\;6H_2O\;=\;C_6H_{12}O_6\;+\;6O_2\uparrow.\)
Общая характеристика элемента
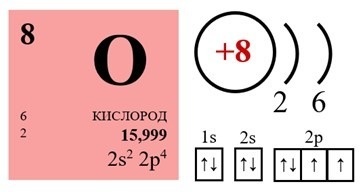
Кислород — это элемент главной подгруппы шестой группы второго периода периодической системы. Обозначается символом O (лат. Oxygenium). Его атомный порядковый номер — 8. Относительная атомная масса Ar(O) = 16.
В соединениях (в оксидах) кислород обычно двухвалентен. В угарном газе CO он трехвалентен. Молекула кислорода \(O_2\) состоит из двух атомов кислорода, связанных ковалентной неполярной связью.
Физические свойства
Это химически активный неметалл, самый легкий элемент из группы халькогенов. Немного тяжелее воздуха. Неэлектролит. При нормальных условиях кислород — это газ без вкуса, цвета и запаха. Его молекула состоит из двух атомов кислорода \(O_2.\)
Слабо растворяется в воде и спирте, хорошо растворяется в расплавленном серебре. Кислород в виде жидкости имеет светло-голубой цвет, а в твердом виде это кристаллы светло-синего цвета.
Химические свойства
Кислород — сильный окислитель, взаимодействующий практически со всеми элементами (кроме благородных металлов, галогенов и инертных газов). Такое взаимодействие называется окислением. Степень окисления элемента = 2. В результате образуются оксиды.
Оксиды — сложные вещества, состоящие из двух элементов, одним из которых является двухвалентный атом кислорода.
\(4K\;+\;O_2\;=\;2K_2O\)
\(2Sr\;+\;O_2\;=\;2SrO\)
При нормальных условиях с кислородом реагируют только наиболее активные элементы: щелочные (Li, Na, K) и щелочноземельные металлы (Ca, Sr, Ba). Остальные элементы вступают в реакцию при нагревании.
Кислород окисляет большинство органических соединений.
\(CH_3CH_2OH\;+\;3O_2\;=\;2CO_2\;+\;3H_2O\)
При сгорании щелочных металлов в кислороде образуются пероксиды. В таких реакциях степень окисления кислорода составляет –1.
\(2Na\;+\;O_2\;=\;Na_2O_2\)
Кислород входит в состав гидрокси-групп. Когда гидрокси-группа связывается с металлом, образовывается основание.
\(2Na+2H_2O=2NaOH+H_2\uparrow\)
Элемент поддерживает процессы дыхания, горения и гниения. Он способствует образованию ржавчины на поверхности металлических изделий.
Аллотропия и аллотропные модификации кислорода
Аллотропия — образование одним элементом нескольких простых веществ.
В свободном виде кислород существует в двух аллотропных модификациях: двухатомная молекула \(O_2\) и трехатомная \(O_3\) (озон).
При нормальных условиях озон — газ голубого цвета со специфическим запахом. В 1899 году Пьер Кюри и Мария Склодовская-Кюри установили, что под воздействием ионизирующего излучения \(O_2\) переходит в \(O_3.\)
Такая реакция происходит при пропускании через воздух электрических разрядов. Она эндотермична и легко обратима. Например, во время грозы:
\(3O_2\;\rightleftarrows\;2O_3. \)
Использование кислорода в промышленности
Применение кислорода основано на его основных свойствах: поддержке дыхания и горения.
Горение:
- сварка металлов;
- металлургия;
- сварка и резка металлов;
- окислитель для ракетного топлива.
Дыхание:
- медицина (газовые смеси, кислородные коктейли, кислородные подушки);
- авиация;
- работа под водой.
Помимо этого, кислород применяют в пищевой промышленности. Он зарегистрирован как пищевая добавка E948, используется как пропеллент и упаковочный газ.
В химической промышленности элемент используют как реактив-окислитель при синтезе веществ.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так