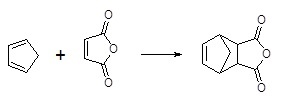
Механизм протекания реакции Дильса-Альдера
Ферментативная реакция Дильса-Альдера — что это такое
Реакцией Дильса-Альдера называют присоединение к ненасыщенному углеводороду или диену, который обладает сопряженными двойными связями соединения и содержит кратные связи (диенофила).
Процесс химической реакции соответствует 1,4–присоединению, в результате чего образуются циклические продукты. Реакция диенового синтеза характерна для диенов и диенофилов, обладающих разным строением. Скорость преобразований и выход возрастают, если диен обладает электронодонорными, а диенофил – электроноакцепторными заместителями.
Одна из важнейших реакций органической химии была открыта в 1928 году выдающимися немецкими химиками О. Дильсом и К. Альдером. Открытие диенового синтеза принесло ученым Нобелевскую премию в 1950 году.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
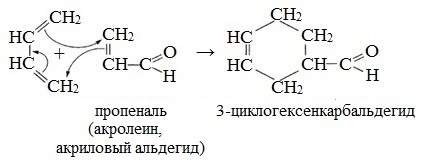
Продукты диенового синтеза в большинстве своем характеризуются высокой биологической активностью. Они активно применяются в фармацевтической промышленности и производстве средств для защиты растений. Синтез разнообразных химических соединений, таких как пестициды циклодиенового ряда, осуществляется благодаря реакции Дильса-Альдера с ее высокой стереоселективностью и региоселективностью, а также широким спектром возможных реагентов. Такие процессы можно наблюдать при вторичном метаболизме живых организмов. Ярким примером служит биосинтез следующих веществ:
- поликетиды в качестве феромонов насекомых;
- изопреноиды в виде витаминов феромонов и гормонов;
- фенилпропаноиды, которые являются структурными компонентами стенок клеток;
- алкалоиды, участвующие в образовании защитных функций растительности от внешних факторов.
Существуют примеры внутримолекулярного варианта реакции Дильса-Альдера. В этом качестве развивается синтез растительного гормона абсциссовой кислоты.
Механизм протекания, при каких условиях
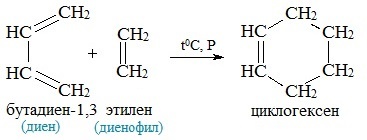
Реагенты при отсутствии заместителей взаимодействуют в достаточно жестких условиях. К примеру, для реакции бутадиена-1,3 и этилена необходим температурный режим более 200 градусов и давление свыше 400 атмосфер. Выход химического процесса при этом небольшой. Если реагенты обладают электронодонорными и электроноакцепторными заместителями, реакция протекает в условиях комнатной температуры или при малом нагреве с количественным выходом. Реакция относится к классу [4+2]-циклоприсоединения. В процессе три тт-связи разрываются и образуются две σ-связи и одна тт-связь. Реакция является одностадийной и характеризуется единственным переходным состоянием. Кроме бутадиена-1,3, вступать в реакцию Дальса-Альдера могут:
- циклические диены;
- гетероциклические диены;
- енины.
Диенофилы представлены следующими типами:
- малеиновый ангидрид;
- тетрацианэтилен;
- акриловая кислота;
- метилакрилат;
- акрилонитрил.
Стереохимия реакции Дильса-Альдера
Реакция Дильса-Альдера характеризуется стереоспецифичностью. Данное понятие обозначают стабильность пространственных конфигураций реагентов в процессе химической реакции. Во время исследований специфики протекания реакции Дильса-Альдера применялись различные реагенты. В итоге было доказано важное стереохимическое правило Альдера. Согласно данному утверждению, в процессах, которые контролируются кинетически, преимущественно образуется изомер с эндо-положением заместителя Х в диенофиле. Таким образом, в бициклической системе заместитель Х и метиленовый мостик занимают транс-положение.
Примеры с малеиновым ангидридом
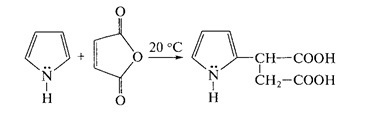
Пиррол достаточно трудно вступает в химическую реакцию 1,4-циклоприсоединения, согласно правилу Дильса-Альдера. Для него характерна реакция заместительного присоединения по второму атому углерода кольца. К примеру, в процессе реакции пиррола и малеинового ангидрида конечным результатом является продукт замещения.
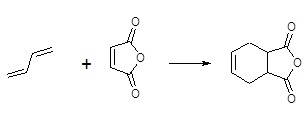
Циклоприсоединение нашло активное применение в области органической химии. С его помощью синтезируют карбоциклические и гетероциклические соединения, которые обладают разнообразным набором и числом атомов в кольце. Этот процесс представляет большой теоретический интерес. В процессе реакции Дильса-Альдера бутадиена-1,3 с малеиновым ангидридом можно получить 1,2,3,6-тетрагидрофталевый ангидрид.
Ангидрид тетрагидрофталевой кислоты представляет собой белое кристаллическое порошкообразное вещество, температура плавления которого составляет от 103 до 104 градусов. Молекулы такого вещества характеризуются циклическим строением.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так